Circulation: 靶向鞘氨醇-1-磷酸信号通路以防止主动脉瓣疾病的进展
Benkhoff, M. et al. Targeting Sphingosine-1-Phosphate Signaling to Prevent the Progression of Aortic Valve Disease. Circulation (2024) doi:10.1161/CIRCULATIONAHA.123.067270.

引言
流行病学 (社会医疗负担)
AVD是西方国家最常见的瓣膜性心脏病,尤其在老年人群中:
- 高患病率:随着人口老龄化,未来20年内患病率预计翻倍。
- 高死亡率:即使轻中度AVD也与更高的死亡率相关,严重病例的3年内死亡率接近50%。
- 生活质量:AVD显著降低患者的生活质量,并增加医疗负担。
现有治疗的局限性:
- 当前唯一的治疗手段是瓣膜置换(手术或介入),适用于晚期病变。
- 缺乏有效的药物可以延缓或预防疾病进展。
目前AVD病理生理机制的研究进展
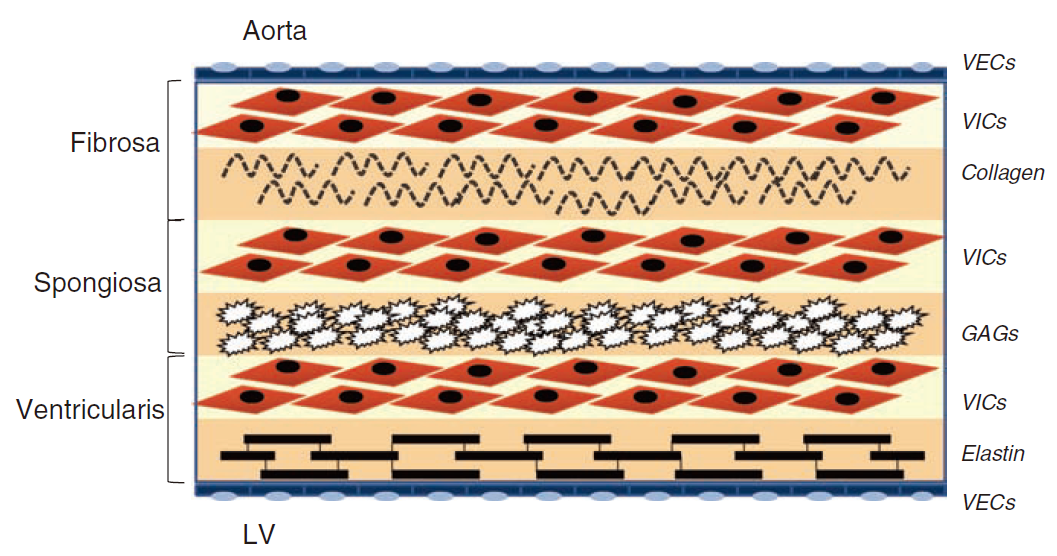
AVD的病理过程:
-
机械损伤和炎症启动病变:
- 高血压和剪切应力异常引发主动脉瓣的机械损伤;
- 内皮功能障碍导致脂质沉积和炎症激活。
-
病理过程以瓣膜钙化为核心,形成“恶性循环”:
- 细胞水平:瓣膜间质细胞(VICs)经历成骨分化,导致骨样结构形成。
- 力学反馈:瓣膜钙化导致瓣膜僵硬和压力增加,进一步加重钙化。
-
信号通路:
- 涉及RANK/RANKL/OPG、Wnt/GSK3β/β-catenin和Notch信号等。
- 这些通路控制成骨转录因子RUNX2和骨形态发生蛋白(BMP-2)的表达。
S1P在钙化中的作用未知:
-
已知S1P(鞘氨醇-1-磷酸)在骨质代谢中具有重要作用:
- 促进成骨细胞的增殖、分化和矿化;
- 增强机械应力下的S1P生成。
-
然而,S1P在主动脉瓣间质细胞中的作用,以及其是否与AVD的钙化和病程进展相关,尚不清楚。
本文的研究目标:
- 探讨S1P信号在主动脉瓣疾病中的病理作用;
- 验证靶向S1P信号通路是否能够阻止或减缓AVD的进展。
本文的主要结果
1. S1P水平对AVD进展的影响
实验设计:
- 高S1P组:使用S1P裂解酶抑制剂DOP提高小鼠体内S1P浓度。
- 低S1P组:通过基因敲除SphK1(S1P生成的关键酶)降低S1P水平。
- 测量指标:心超:瓣膜峰值速度(AV Peak Velocity)、瓣膜平均压力梯度(AV Mean Pressure Gradient)、瓣膜厚度及心脏射血分数(EF)。组织学:茜素红(ARS) 染色
图表内容与解析:
-
高S1P组(腹腔注射 DOP) :
-
图1A和1B显示,DOP处理后,小鼠瓣膜峰值速度和压力梯度显著增加,表明AVD进展加快。

-
图1C中的组织学结果(Alizarin Red染色)显示,高S1P组瓣膜显著增厚。

-
图1D和1E表明,高S1P组射血分数显著降低,瓣膜面积缩小,提示心脏功能受损。

-
心脏结构、超声心动图测定的左心室内径以及左心室质量在此时间点没有差异(图1F和1G),但高 S1P 组小鼠术后死亡率是升高的。

-
-
低S1P组(SphK1缺失) :
-
图1J和1K显示,SphK1基因敲除的小鼠瓣膜峰值速度和压力梯度显著降低,AVD进展明显减缓。


-
图1L显示,即使在低S1P背景下,DOP处理仍可逆转保护作用,加重AVD,进一步证实高S1P浓度对疾病进展的推动作用。图1M中的射血分数提升,心脏功能改善。

-
同时,图1S显示钙化程度减轻

-
-
RANKL/OPG 比率:
- RANKL 血浆水平在 SphK1-/- 中相较于对照组增加,并被 DOP 抑制(图 1T),而 OPG 在 DOP 处理的 SphK1-/- 中增加(图 1U)。与对照组相比,SphK1-/- 动物的 RANKL/OPG 比率减少,并在 DOP 处理后再次增加(图 1V)。RANKL/OPG 比率与 AS 严重性测量的峰值速度之间存在明显的负相关(图 1W)。

- RANKL 血浆水平在 SphK1-/- 中相较于对照组增加,并被 DOP 抑制(图 1T),而 OPG 在 DOP 处理的 SphK1-/- 中增加(图 1U)。与对照组相比,SphK1-/- 动物的 RANKL/OPG 比率减少,并在 DOP 处理后再次增加(图 1V)。RANKL/OPG 比率与 AS 严重性测量的峰值速度之间存在明显的负相关(图 1W)。
2. S1PR2在AVD中的作用
由于S1P/S1PR2信号传导已被证明能够激活成骨细胞,并且S1PR2在血管外泌体中表达,我们检查了S1PR2-/-小鼠中AVD的发展。这些小鼠的S1P水平与野生型小鼠相似。
实验设计:
- S1PR2基因敲除组:探讨S1P通过S1PR2信号通路在AVD中的作用。
- 药物抑制组:使用S1PR2拮抗剂JTE-013评估其治疗潜力。
图表内容与解析:
-
S1PR2缺失组:
-
图2A和2B显示,与野生型相比,S1PR2缺失小鼠的瓣膜峰值速度和压力梯度显著降低,提示S1PR2在AVD进展中的关键作用。

-
图2C显示S1PR2缺失小鼠瓣膜面积更大,且钙化程度较低,进一步支持S1PR2的病理作用。


-
S1PR2缺失小鼠心功能也是有所改善的

-
-
药物抑制(JTE-013) :
-
图2K和2L表明,JTE-013在AVD诱导6小时后开始治疗,可显著减缓AVD进展,降低瓣膜峰值速度和压力梯度。

-
即使停止治疗,心脏功能的改善仍维持至12周,显示其潜在的长效保护作用。

-
3. S1P诱导VIC钙化的机制
实验设计:
- 在人类瓣膜间质细胞(VICs)中模拟钙化条件,观察S1P对RUNX2和OPG表达的影响。
图表内容与解析:
-
S1P诱导钙化:
-
图3A显示,S1P显著增强了VIC钙化(Alizarin Red染色),但S1PR2抑制剂JTE-013可以完全阻断这种作用。
抑制S1PR2(JTE-013)而非S1PR1(W146)或S1PR3(TY-52156)防止了S1P诱导的VICs钙化

-
-
分子机制:
-
S1P通过S1PR2上调RUNX2、Osterix、OPG、Vinculin基因表达,从而推动钙化信号通路。


-
图3H显示,S1P刺激GSK3β磷酸化,从而激活Wnt-β-catenin信号,这进一步促进了钙化。

-
4. 人瓣膜组织的S1P和剪切应力(shear stress)的关系
实验设计:
- 分析来自AVD患者的钙化瓣膜组织,测定S1P浓度和相关基因表达。
- 使用CMR影像技术评估力学应力对瓣膜的影响。
图表内容与解析:
-
钙化瓣膜的S1P水平:
-
图4A显示,AVD患者钙化瓣膜中的S1P水平是健康瓣膜的2.7倍。而血液中的浓度是接近的,说明 S1P 能在瓣膜组织内富集。


-
图4B显示SphK1(S1P生成酶)表达增加,而S1PR2表达无显著变化(图4C)。
-
-
力学应力作用:
-
图4E和4F显示,CMR图像中,AVD患者瓣膜的剪切应力显著增加。

-
单纯体外机械拉伸(10%,1 Hz)诱导VIC中S1P生成增加,并由SphK1酶介导(使用 PF-543 抑制k1 酶后,C17-S1P 减少)。


-
原文讨论
本文主要发现和贡献
-
S1P/S1PR2信号在AVD中的关键作用:
- 增加S1P水平会促进瓣膜钙化,加重AVD进展,损害心脏功能;
- 降低S1P水平或基因敲除S1PR2则显著缓解AVD进展。
-
机制简述
- 机械应力诱导的SphK1生成增加而在瓣膜组织局部升高 S1P 水平;
- VICs在S1P刺激下,激活成骨分化相关基因(如RUNX2和OPG),通过Wnt通路促进钙化。
-
新颖性:
- 首次揭示S1P通过S1PR2介导瓣膜间质细胞(VICs)的成骨分化,并通过RUNX2/OPG和GSK3β-Wnt-β-catenin信号通路促进钙化。
-
药物干预潜力:
-
当前AVD缺乏有效的药物治疗,研究结果表明S1PR2和SphK1可能是潜在的治疗靶点。
-
S1PR2拮抗剂(JTE-013)可有效阻止AVD进展,表现为减缓瓣膜钙化和改善心脏功能。
-
局限性
-
小鼠AVD模型的力学应力环境和瓣膜解剖结构与人类不同,可能限制研究的外推性。
-
目前研究主要基于动物模型和离体人类组织,缺乏大规模临床试验数据支持。
-
S1PR2抑制剂的长期作用,特别是对骨骼健康的潜在影响,尚未深入评估。
未来研究方向
机制的进一步探索
- 验证力学应力如何与其他病理信号(如炎症因子)交互作用,驱动AVD进展。
- 深入研究S1P与其他成骨信号(如BMP-2、Notch)的协同作用。
药物开发
- 针对S1PR2的选择性抑制剂是否适用于长期治疗。
- 探索SphK1抑制剂的作用,并与S1PR2拮抗剂进行比较。
临床研究
- 开展针对AVD早期患者的S1PR2抑制剂临床试验,验证疗效和安全性。
- 结合影像学技术(如CMR)动态监测瓣膜钙化和剪切应力的变化。
我的讨论
逻辑回顾

- 从动物模型切入研究主题,探索S1P对 AVD 进展的影响,以及药物干预的有效性
- 锁定受体S1PR2 为效应受体
- 探索下游机制
- 回到开头思考 S1P 在瓣膜组织内升高的原因:局部剪切力。最终形成逻辑闭环。
学到了什么
-
动物模型的重要性:可以作为研究起点进行切入的,不一定要从人类样本的组织学检测开始
-
创新性足够好时,没有生信分析支持也可以发高分
-
开拓视野:机械应力与生物信号的相关性
-
实验方法:
- C17 Sphingosine Assay:同位素标记+质谱分析
- 小鼠主动脉瓣口面积的计算公式:

- CMR(Cardiovascular Magnetic Resonance)评估主动脉瓣的剪切应力和血流动力学特性
- VIC 的拉伸实验:培养板被放置在一个循环拉伸系统(Flex Jr Tension System)上。施加的循环机械拉伸呈心形波纹,产生的压力模式模拟了心跳产生的实际压力波,最大振幅为10%,持续24小时。拉伸频率为1 Hz。
局限性探讨
-
作为读者比较好奇本研究切入S1P的原因是什么?但文中未给出的说明。
-
力学应力与生物信号之间的因果链条未完全闭合:文章多次提到机械应力增加SphK1的活性并导致局部S1P水平升高,但对于力学应力如何启动SphK1的激活缺乏深入阐释。例如,是否需要特定的信号分子参与?
-
钙化机制的时间线描述略显模糊:如S1P刺激VICs后不同时间点RUNX2/OPG的变化
-
小鼠模型给药方式的疑问:如何确定给药剂量和给药时间?
- DOP:饮用水给药,180mg/L,造模前 1 周开始直到实验结束(预防?)
- JTE-013:腹腔注射,按体重30mg/kg,造模后 6h 首次给药,每日 1 次,仅持续 2 周(早期干预?)
本文探讨了鞘氨醇-1-磷酸(S1P)信号通路在主动脉瓣疾病(AVD)进展中的作用。研究显示,随着人口老龄化,AVD 在老年人群中日益普遍,现有的治疗手段主要限于瓣膜置换,缺乏有效的药物干预。本研究通过小鼠模型验证了高S1P水平加速AVD进展的机制,并发现降低S1P水平可显著减缓病程。此外,S1PR2的脱落也表明其在AVD发展中的关键角色。研究结果表明,靶向S1P信号通路可能成为延缓AVD进展的新策略,为未来药物开发提供了理论基础。这项研究为主动脉瓣疾病的治疗提供了新的视角,强调了S1P在钙化过程中的潜在影响,以及针对S1P信号通路的干预可能带来的临床益处。





































暂无评论内容