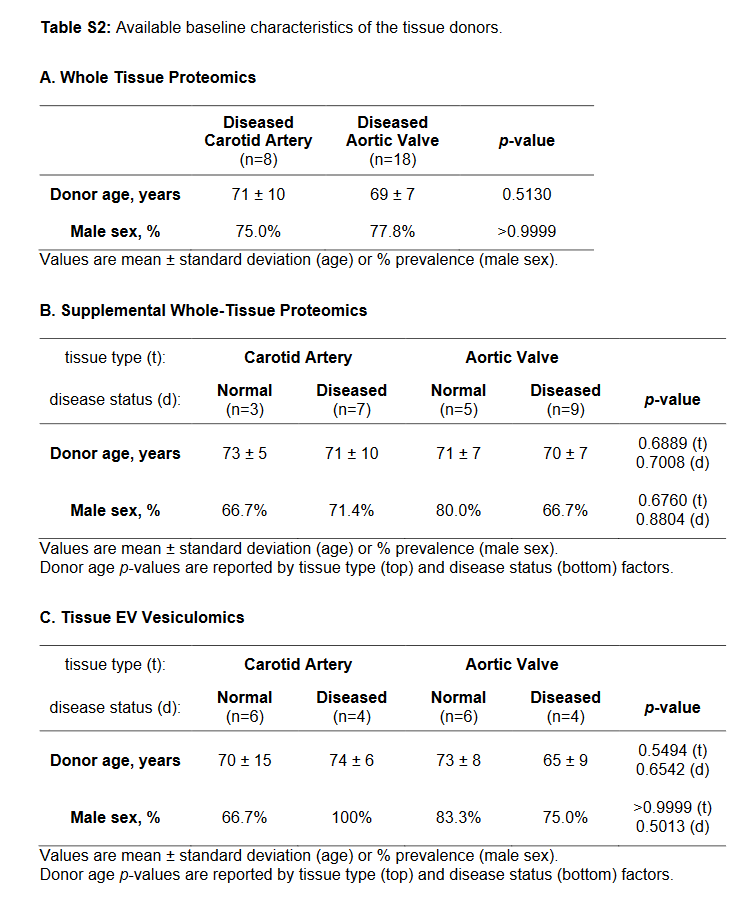
Blaser MC, Buffolo F, Halu A, Turner ME, Schlotter F, Higashi H, Pantano L, Clift CL, Saddic LA, Atkins SK, Rogers MA, Pham T, Vromman A, Shvartz E, Sukhova GK, Monticone S, Camussi G, Robson SC, Body SC, Muehlschlegel JD, Singh SA, Aikawa M, Aikawa E. Multiomics of Tissue Extracellular Vesicles Identifies Unique Modulators of Atherosclerosis and Calcific Aortic Valve Stenosis. Circulation. 2023;
研究背景
- 动脉钙化 vs 瓣膜钙化:尽管动脉和心脏瓣膜的病理性矿化有许多相同的风险因素,且组织病理学上相似,但仅有25%到50%的瓣膜钙化患者也会发展血管钙化,表明两者存在不同的机制。
- CAVD vs AS: 不到50%的主动脉瓣钙化患者伴有动脉粥样硬化,表明存在不同的发病机制。尽管循环外细胞囊泡(EVs)作为心血管疾病的生物标志物起作用,但 tissue-entrapped EVs 与早期矿化有关,但它们的含量、功能和对疾病的贡献仍然未知。
- 他汀类药物可以成功缓解动脉粥样硬化患者的炎症并降低胆固醇,却无法改善主动脉瓣狭窄患者预后。
- 该研究团队在2016年已经证明:钙化矿物质的形成和成熟是一系列事件的结果,其中包括钙化细胞外囊泡的聚集、微钙化的形成以及最终大面积钙化。(PMID: 26752654,Nature Materials)
- 2018年该团队发表了基于主动脉瓣不同组织学分层的多组学研究数据。(PMID: 29588317, Circulation)
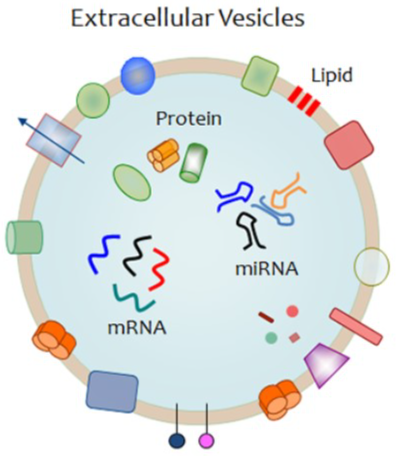
关于EVs的一些知识
- EVs 含有多种生物活性物质(脂质、蛋白质和mRNA/microRNAs),并可以介导细胞间的通讯。
- 它们是心血管钙化的重要驱动因子。促钙化的EVs或许能解释抗脂治疗无效的原因。
- 心血管疾病研究领域,循环体外囊泡水平在冠心病患者中升高,与心血管死亡、血管重建以及发生主要不良心血管事件的风险增加有关。但目前对心血管组织中的囊泡 tissue-entrapped EVs 研究还不足。
- 体外研究发现,病变血管和瓣膜中的EVs (巨噬细胞,SMC分泌)能直接促进钙化。
- 最近的研究也明确了AS斑块以及钙化的血管组织中含有EVs。
- 与从生物液体中直接分离外泌体(EVs)不同,从组织中提取足够纯净、优质和数量充足的EVs以供后续应用是一个巨大的挑战。因此,组织EV的成分很少被研究,仅仅限于更容易破坏的脑部或肿瘤样本。
-

研究路线
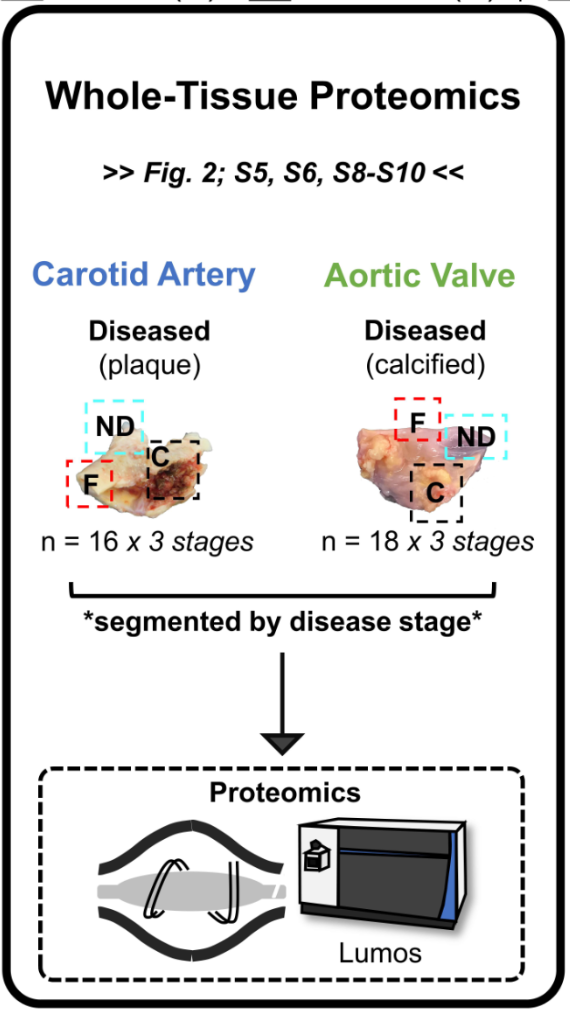
全组织蛋白组学 Whole-Tissue Proteomics
- 颈动脉斑块(n=16)+钙化AV(n=18),疾病分区
-

-
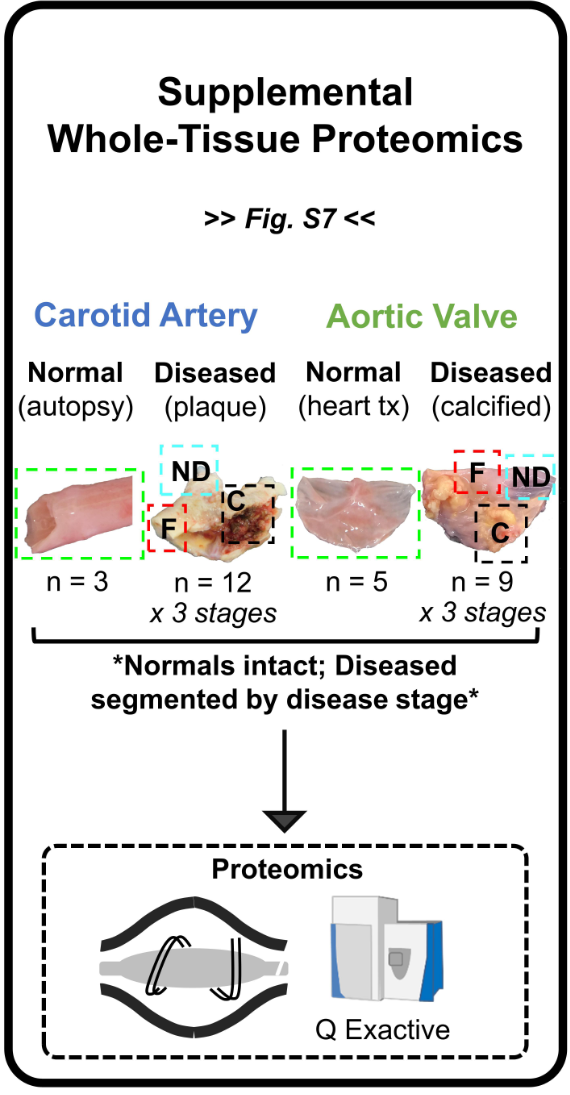
补充全组织蛋白组 Supplemental Whole-Tissue Proteomics
- 完整的正常标本+病变标本分区。病变标本使用了上一部分的相同供体。
-

-
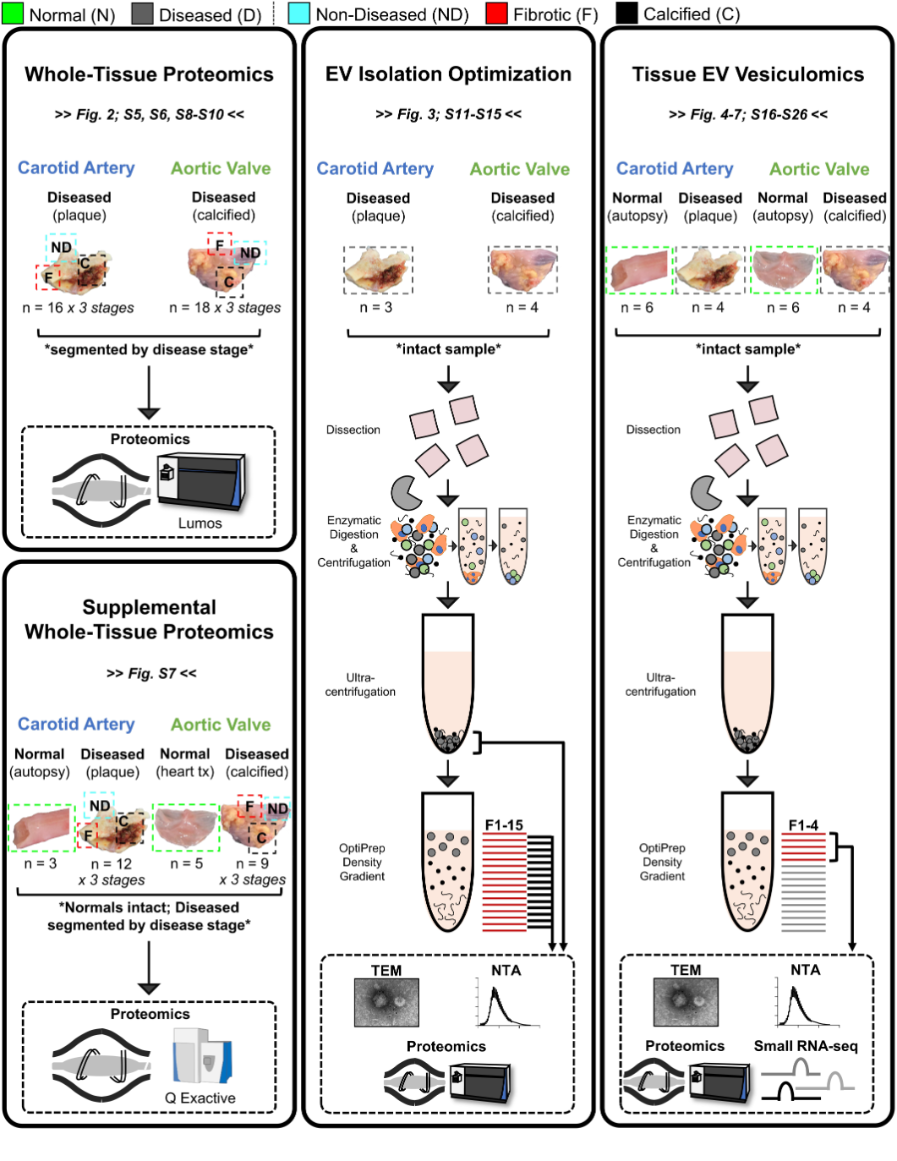
分离EV过程的优化 EV Isolation Optimization
- 颈动脉斑块(n=3)+钙化AV(n=4)
组织EV囊泡组学 Tissue EV Vesiculomics
-

结果解读
全组织蛋白质组学识别了血管和瓣膜疾病进展的独特驱动因子,以及保守的EV相关蛋白
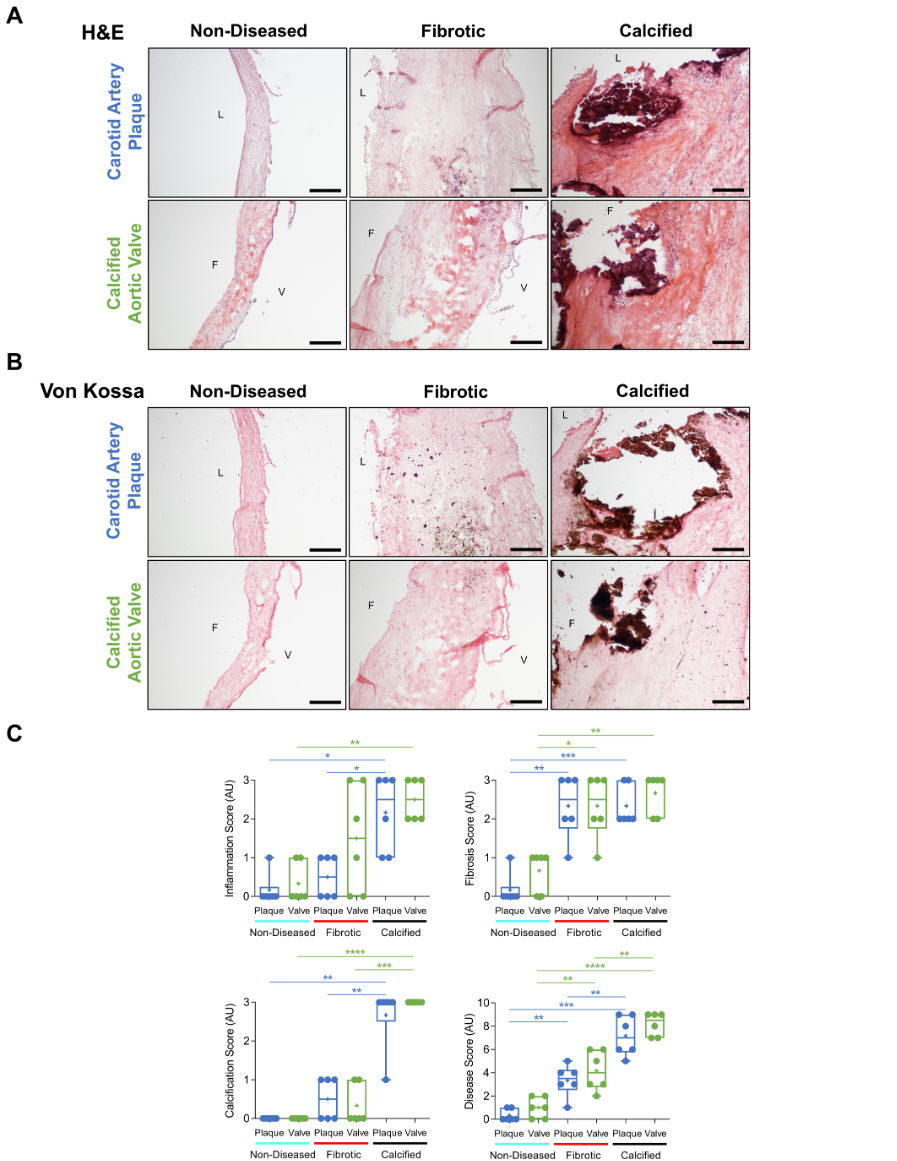
1. 年龄、性别、组织病变程度的匹配(劲动脉–瓣膜)
2. 主成分分析
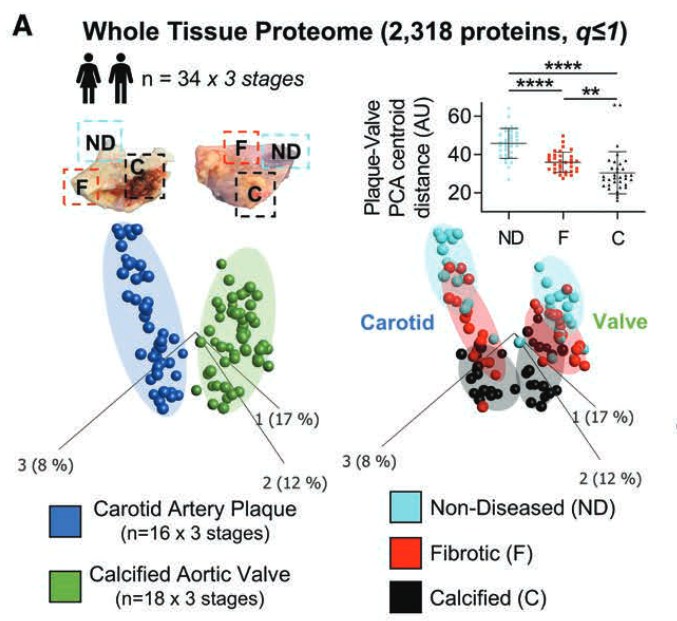
- 组织和疾病阶段具有明显的聚类特征
- 疾病进展期间颈动脉和瓣膜组织蛋白质的聚集显著。(疾病越进展,特征越明显!)
3. 疾病分区的差异蛋白分析
- 颈动脉斑块中:
- 细胞粘附、迁移和胞内骨架(SYNPO2, PLP2, CALD1, NEXN, SMTN和COTL1);
- 平滑肌细胞可塑性(LMOD1);
- 炎症和脂质代谢(ORM2, CXCL16, CASP1, CLIC1, CD84, GRN, CTSG, DDAH1和NPC2);
- 钙化(OSCAR和ADAM10)
- 通路网络分析:机械转导、血小板活化、脂蛋白和能量代谢以及FcεRI信号传导和免疫应答联系起来
- AV钙化相关的蛋白质:
- 钙化/淀粉样变(GAS6、SMOC1、PRPSAP1、TTR、CA1、CLEC11A和TNFRSF11B)、细胞凋亡(ANP32A和PDCD6)
- 炎症和补体级联反应(CRP、C4A、HBB、HBD、PROC、MASP1和SERPINE1)
- 组蛋白/核小体功能(H2BC17、U2AF2和NAP1L1)
- 显著富集的途径包括Nonsense-mediated decay (NMD)^(Nonsense-mediated decay (NMD) 是一种生物学监控机制,它负责降解含有早终密码子 (premature termination codons, PTCs) 的 mRNA。早终密码子会导致蛋白质翻译过程过早结束,从而产生不完整和可能具有毒性的蛋白质。NMD 机制通过检测并降解这些异常 mRNA,避免了这些有害蛋白质的产生。 NMD 机制在生物体中发挥着重要的调控作用。例如,它参与了基因表达的精细调控、发育过程中的细胞决定以及对应激反应等多个生物过程。此外,NMD 机制的缺陷与多种遗传病和其他疾病的发生有关。 要注意的是,NMD 是高度复杂的,涉及多种不同的生物学过程和分子机制。具体的操作方式可能会因生物种类、组织类型,以及具体环境等因素的不同而不同。)^、补体级联反应、羧化与止血^(Carboxylation:是一个化学反应过程,通过这个过程,羧酸基(-COOH)被添加到一个分子上。在生物体内,这一过程通常由特定的酶催化。一个著名的例子是在凝血过程中的维生素K依赖性的γ-羧基化,这一过程对于几种凝血因子(如凝血因子II、VII、IX和X)的活化至关重要。 Hemostasis:是指体内用于阻止出血并维持血液在血管内流动的一系列生理过程。这一过程包括三个主要步骤:血管痉挛(阻止血液流动)、血小板聚集形成血栓(暂时封闭损伤处),以及凝血(形成稳定的血栓)。在这个过程中,上述提到的通过羧基化活化的凝血因子发挥关键作用。 总的来说,carboxylation 和 hemostasis 是相互关联的。在体内,羧酸化过程被用于激活几种关键的凝血因子,这些凝血因子对于血液凝固和止血过程(即hemostasis)至关重要。如果羧酸化过程受到阻碍(例如,由于维生素K缺乏),可能会导致凝血问题,如出血或血栓形成。)^、细胞凋亡和细胞分裂调控等。
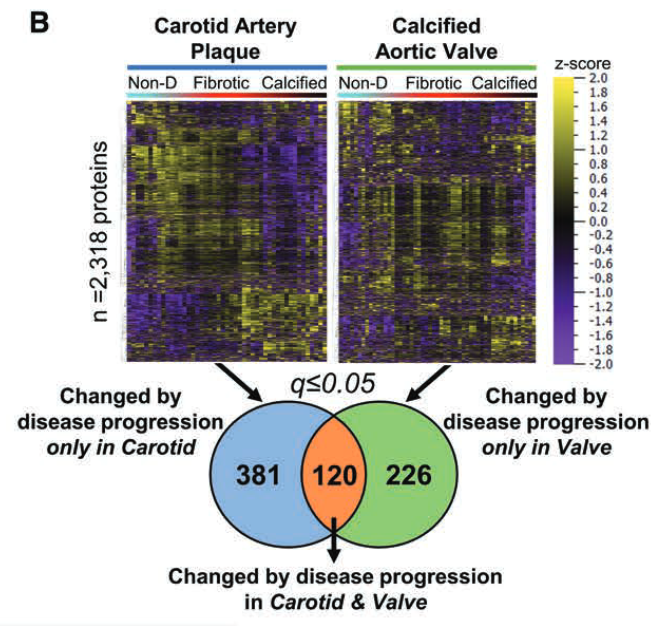
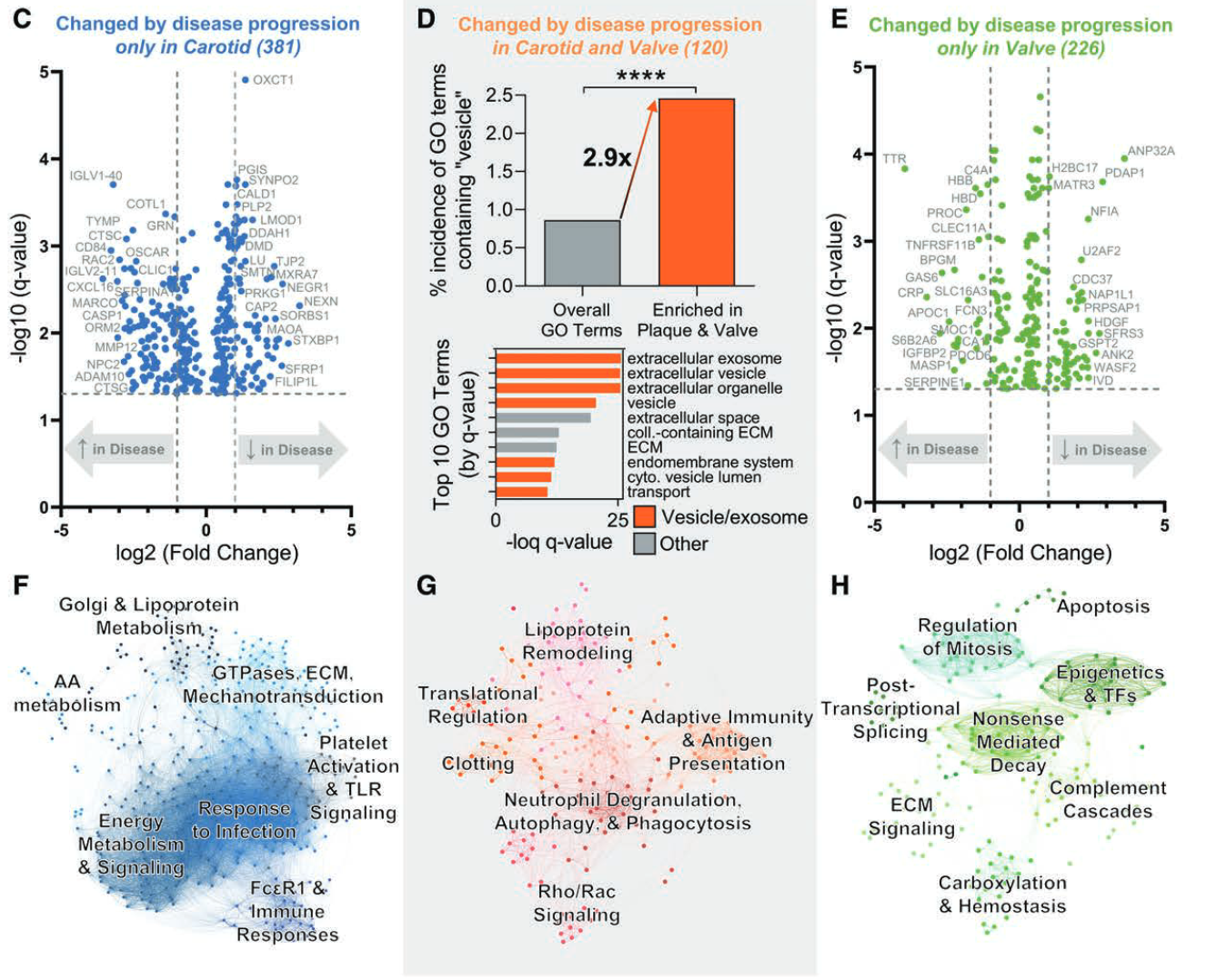
- 共有120种蛋白质具有相同的变化趋势。
- 与囊泡相关的GO术语增加了2.9倍(P<0.0001)。
- 最显著富集的GO术语中有70%与EVs、外泌体、外吐或分泌相关。
- 通路网络:与脂蛋白重塑、适应性免疫/抗原呈递、自噬/吞噬以及各种受体介导的信号级联相关。
- EV相关功能在颈动脉斑块和钙化AV病理过程中非常常见。
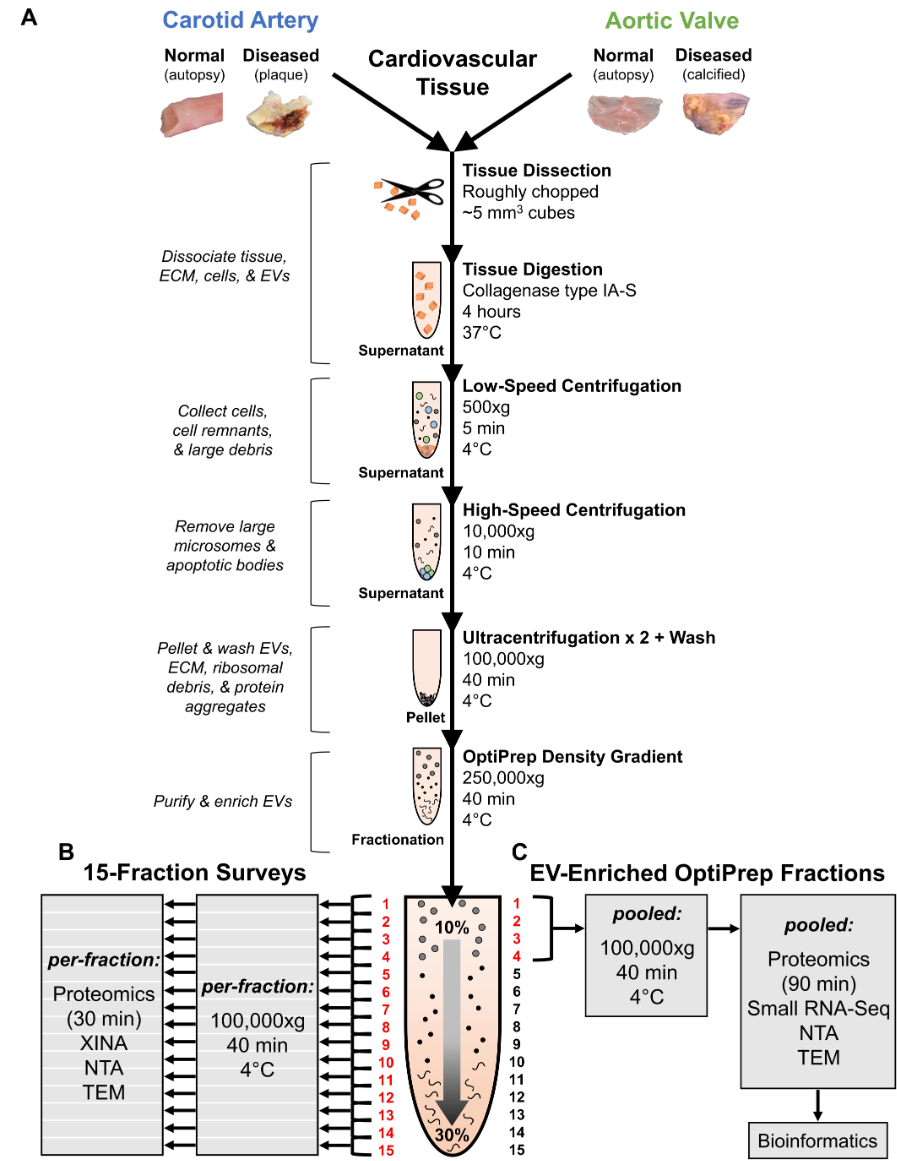
组织外泌体的分离、纯化与鉴定
1. 分离纯化的步骤
- 梯度密度超速离心法是分离体液外泌体的常用方法
- 剪碎组织
- 酶解消化
- 低速离心
- 高速离心
- 超速离心1
- 超速离心2
- 15级密度分离
- 如何鉴定组织EVs在哪些密度层级呢?
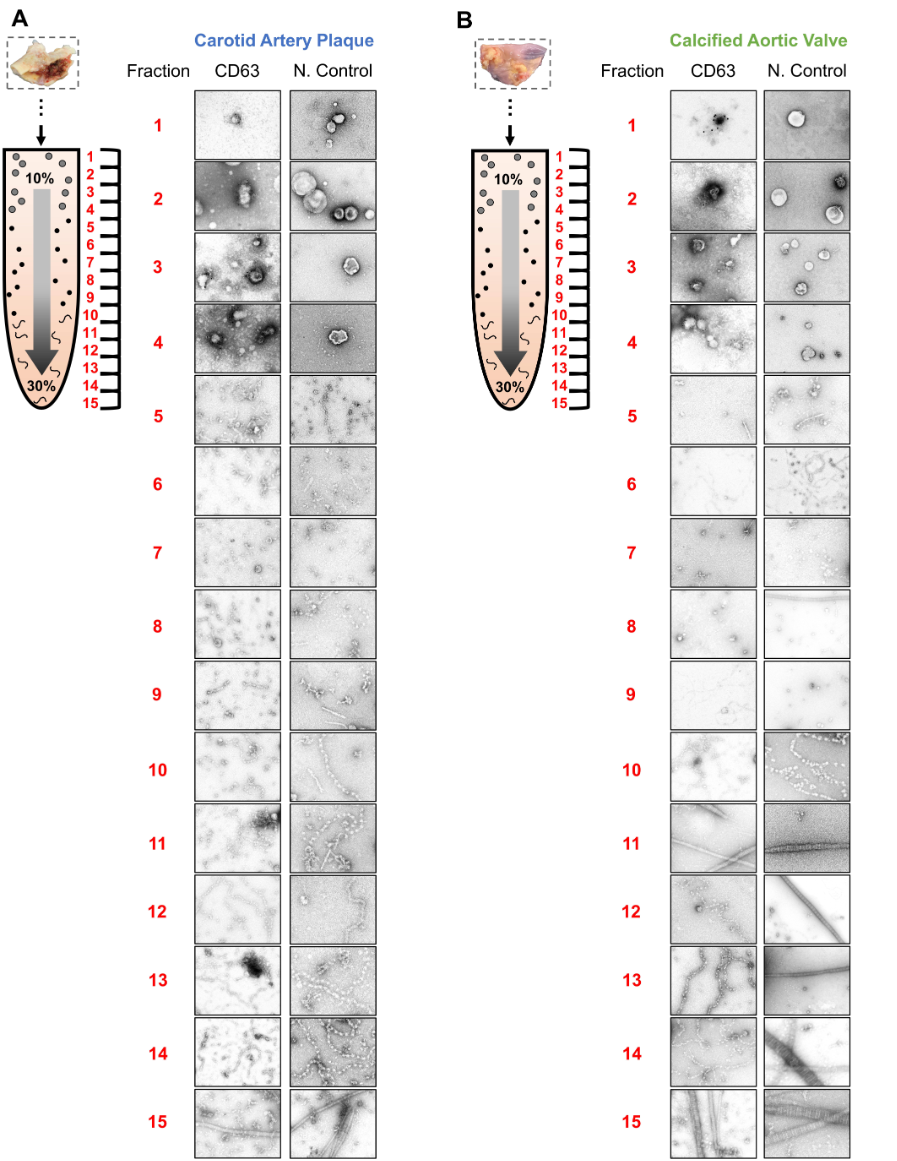
2. 对每一个密度层级进行蛋白组分析发现组织EVs标记物在 F1-4 富集
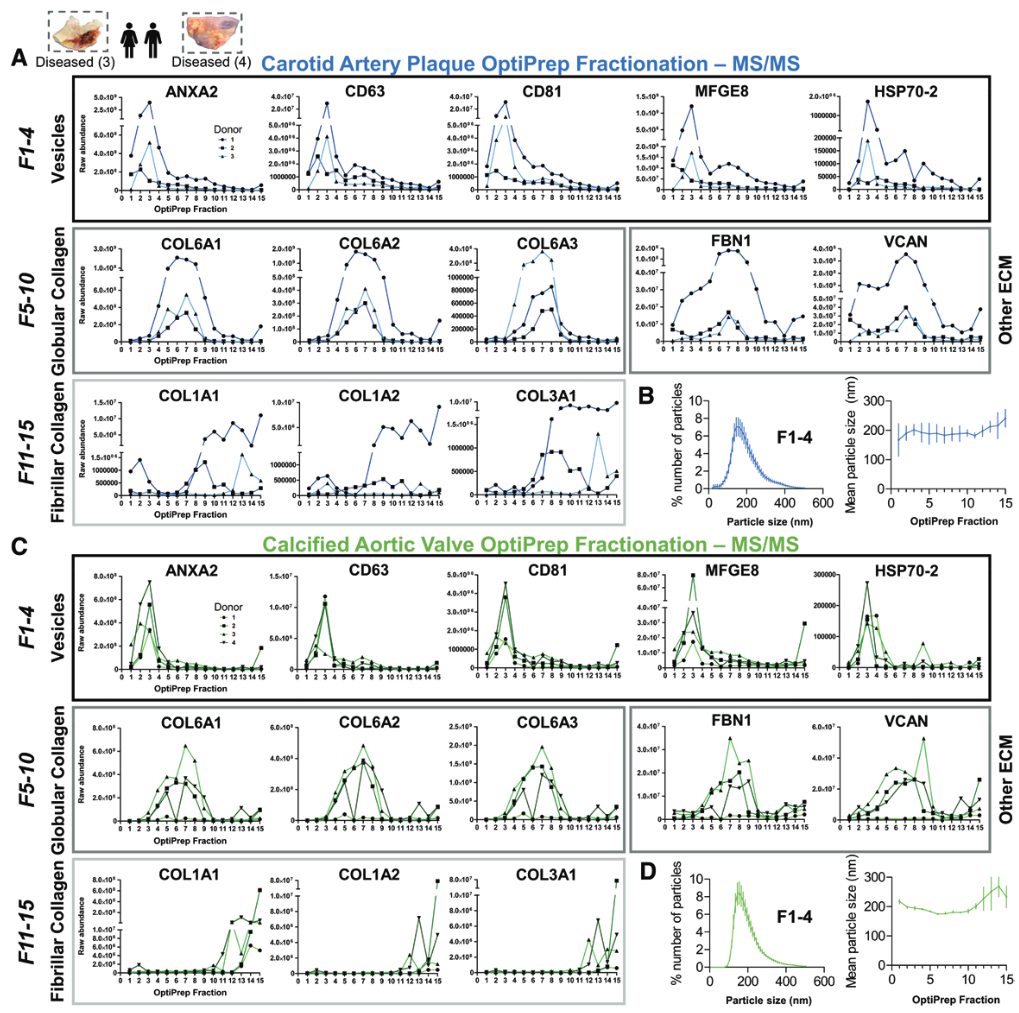
- 使用无标签蛋白质组学方法,对每个密度梯度分离样品进行分析,以评估外泌体聚集的位置,共鉴定了1491种蛋白质,并发现22种外泌体标记蛋白质(如,annexins、CD63/81、flotillins、HSP70s、TSG101和tetraspanins)富集于颈动脉斑块和钙化动脉瓣的4个最低密度的部分中,其中在第3个部分中达到峰值。
- F5-10 中含有大量球形胶原
- 而F11-15含有大量纤维状胶原
-

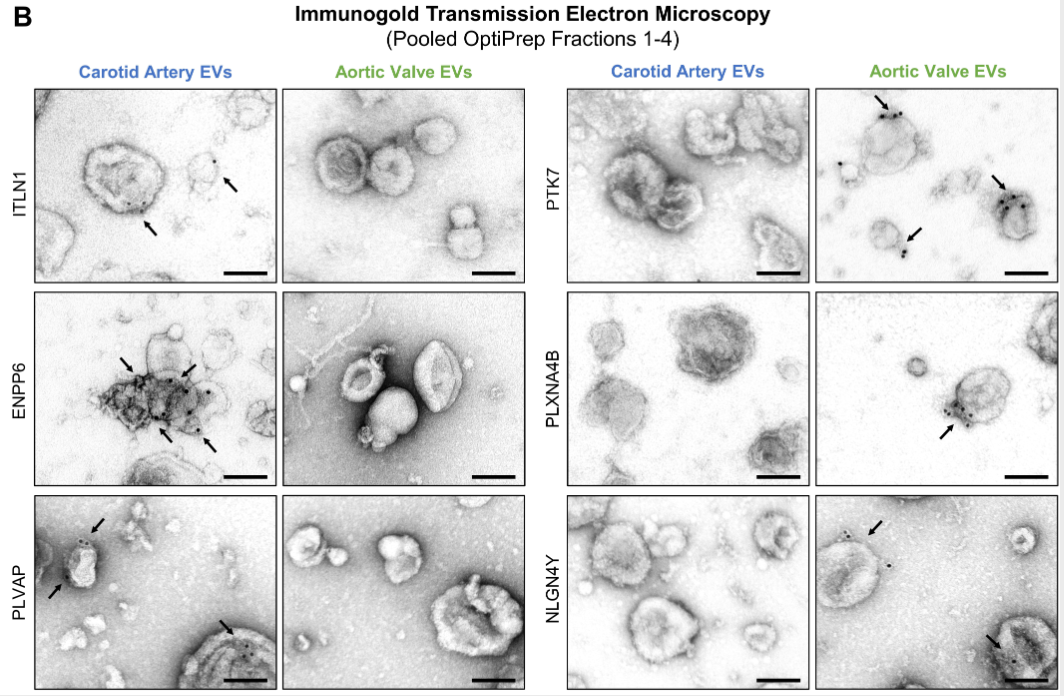
3. 免疫金投射电镜验证
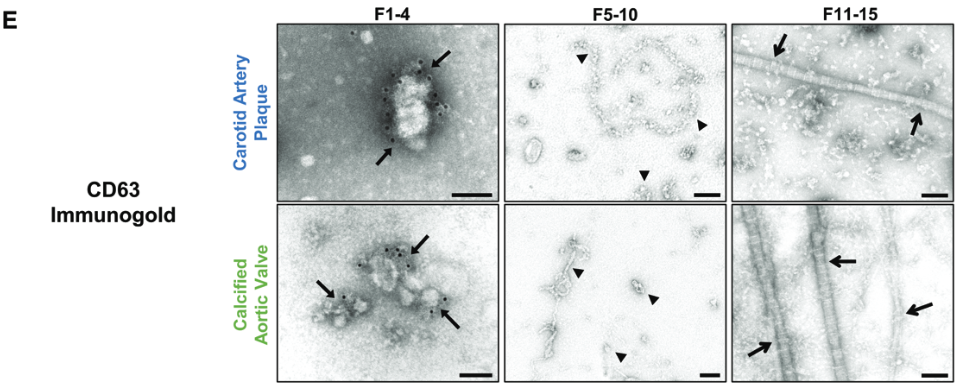
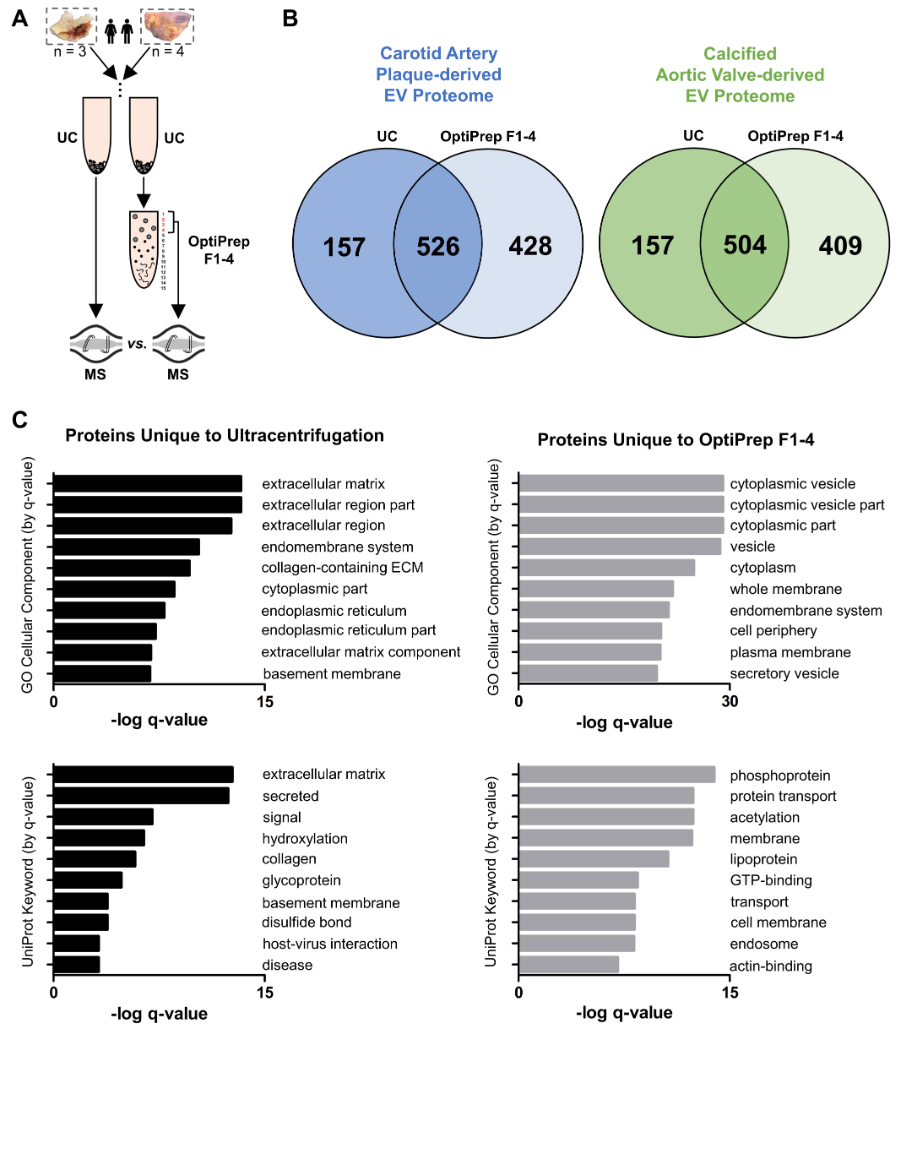
4. 该方法与单纯的超速离心法分离EVs结果比较
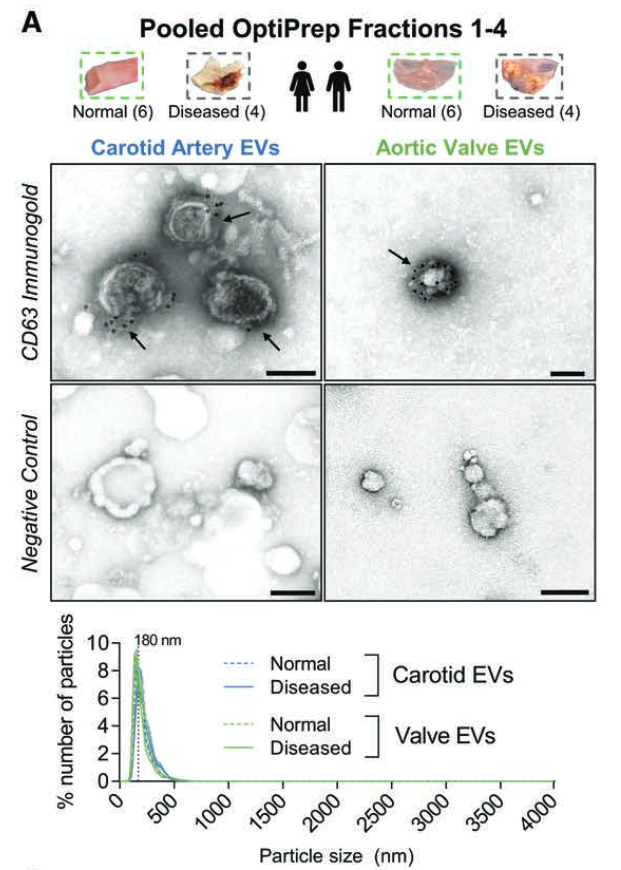
在正常/病变的血管和瓣膜中组织 EV 蛋白组
1. 使用上文方法,分离密度F1-4,验证成功分离到了EVs
2. 差异分析结果
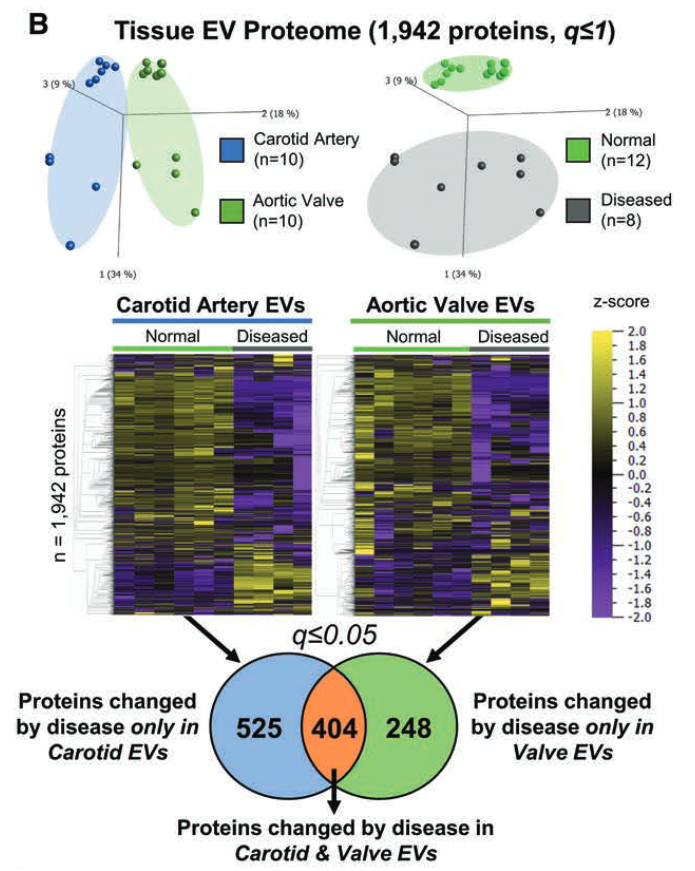
3. 全组织(分区)与组织EV组学的比较
全组织
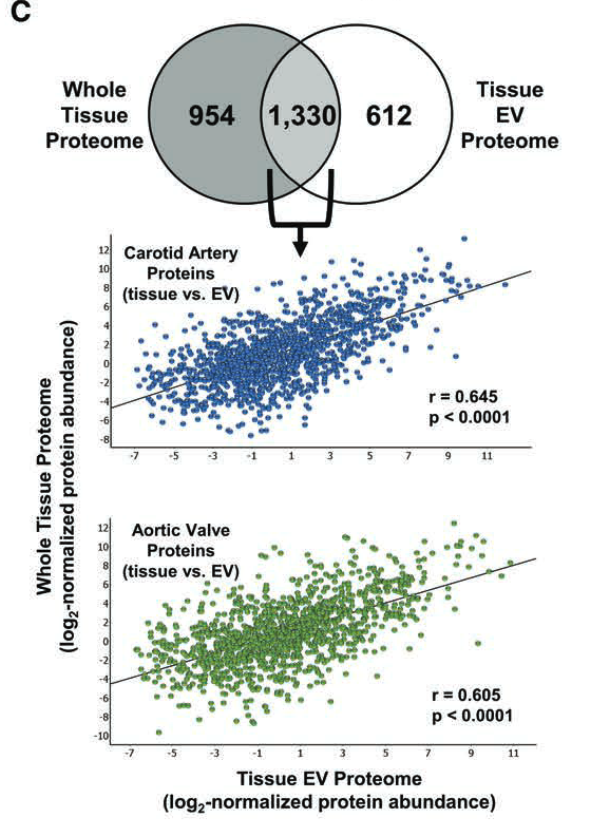
- 两者有45.9%的重叠(1330个蛋白)
- 重叠部分的蛋白水平在两者间的相关性较高
- 表明:EVs 反映了在全组织水平发现的一些表型,但不是全部,而且可能具有全组织组学所遗漏的重要生物学功能
4. 通路分析
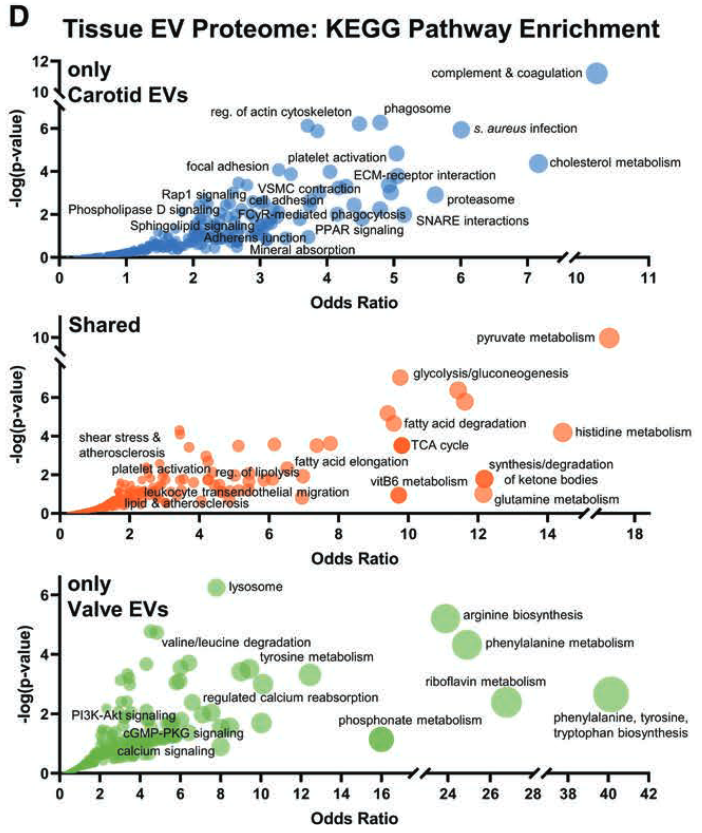
- Share的通路大多与心血管钙化有关
- 白细胞跨内皮迁移
- 脂肪分解/脂肪酸降解
- 葡萄糖生成和丙酮酸代谢
- 颈动脉差异通路中涉及:补体和凝血级联、血小板活化和机械传导(包括病灶粘附、细胞骨架调节、ECM-受体相互作用和细胞粘附)
- 瓣膜差异通路富集于:氨基酸代谢、钙重吸收、PI3K-Akt 信号转导和 cGMP 信号转导相关的 AV 发病机制。
5. 通过免疫金-透射电子显微镜部分验证不同组织中富集的EV蛋白
小RNA测序揭示组织EV中非编码miRNA组
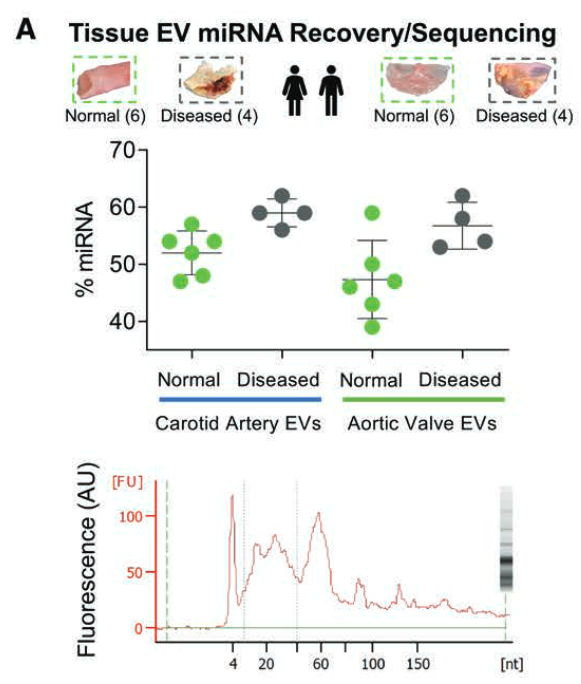
- 疾病组miRNA含量更高
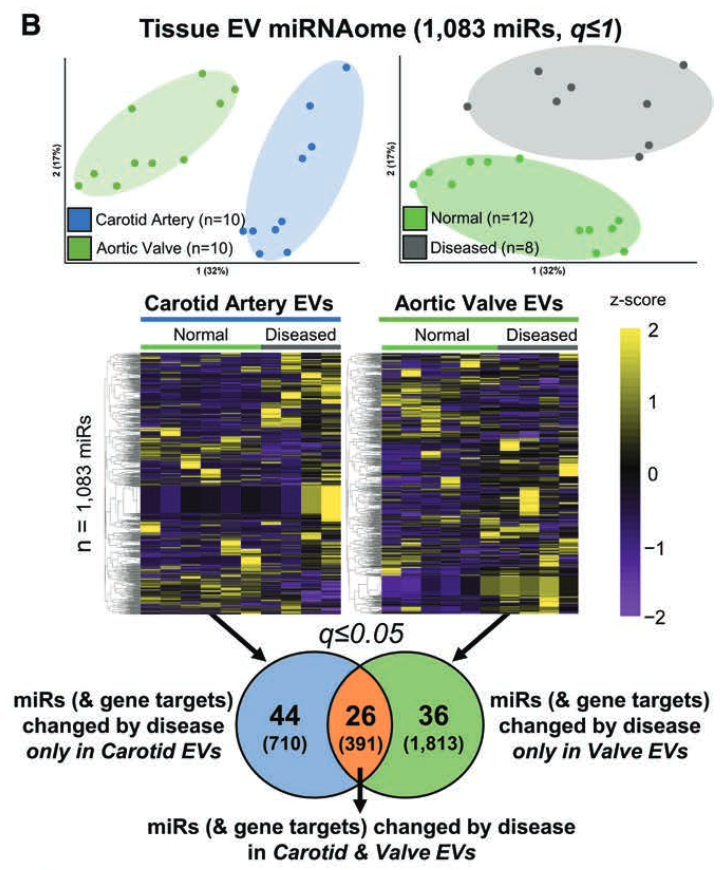
- 共检测到 1083 个 EV 源性的 miRs ;它们的表达按组织类型和疾病状态进行了分类。
- 有 44 个 EV miRs 仅在颈动脉中因疾病而发生不同程度的富集,36 个 miRs 仅在瓣膜中发生变化,26 个 miRs 在两种组织类型的 EV 中都发生了变化。
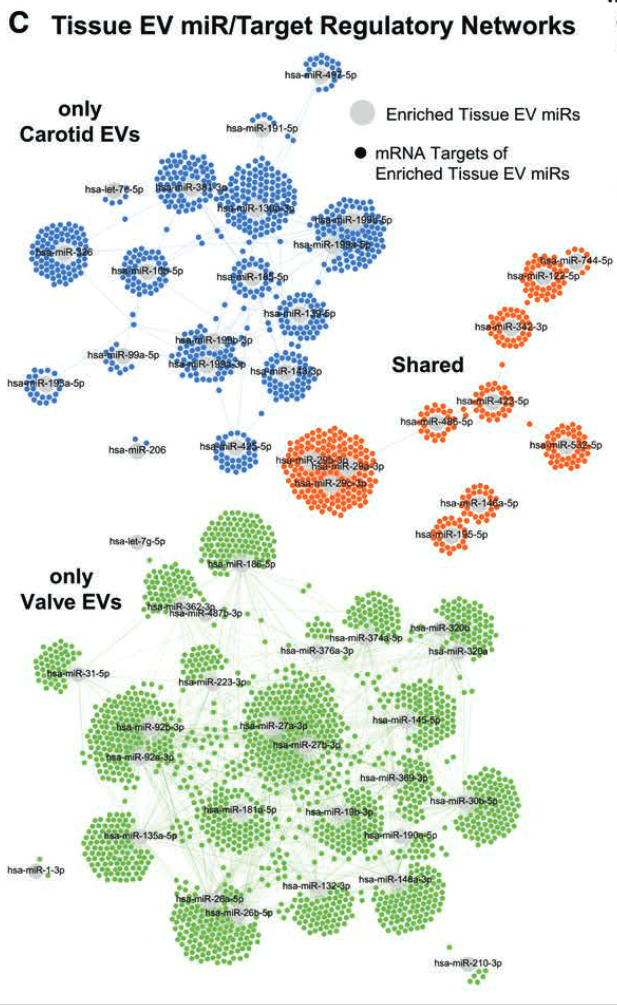
- 调控网络分析
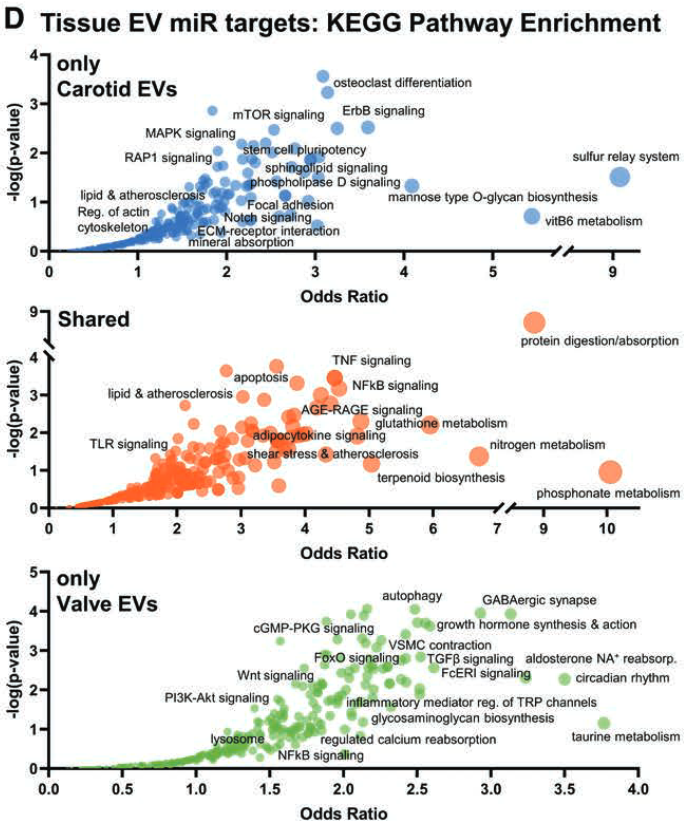
- 通路分析
囊泡组学的整合分析鉴定具有保守性的心血管组织EV运载物
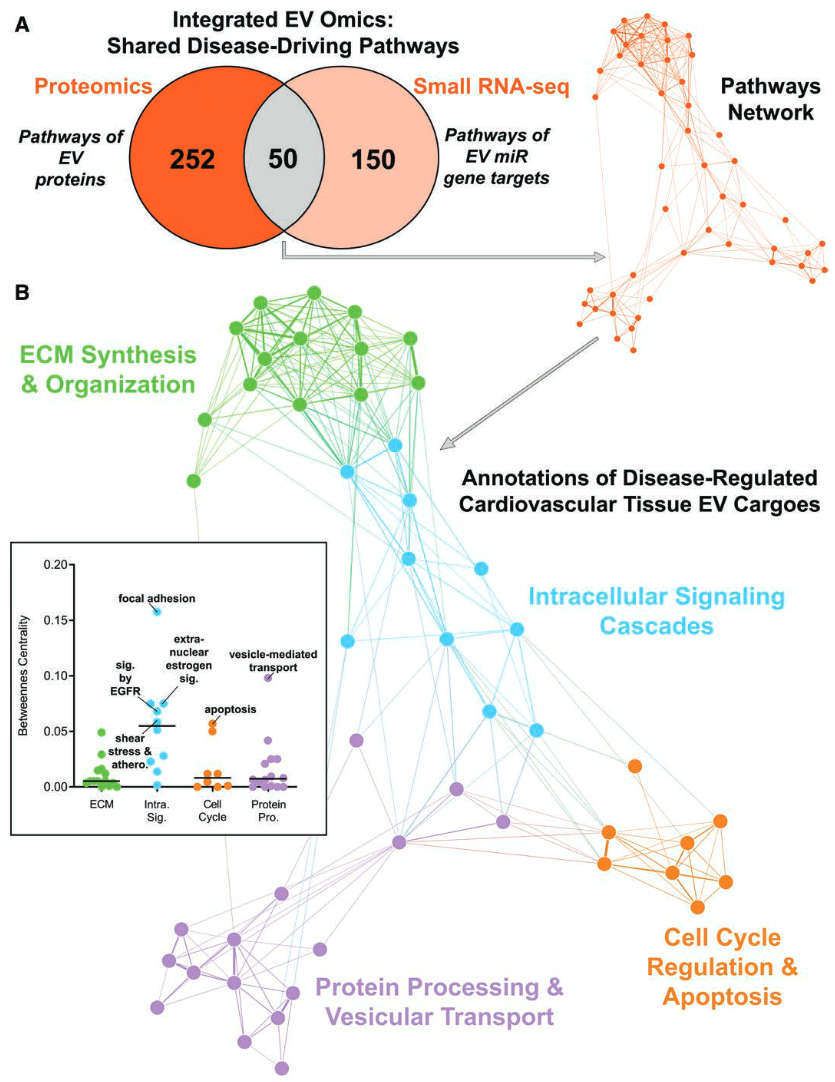
- 从通路层面将EV蛋白组和miRNA组学进行整合
- 50个共同激活的通路,它们代表了心血管组织 EV 携带的疾病驱动因素的保守性。
- 整个共享通路网络可以聚类为 4 个不同的注释,包括细胞内信号级联的调节、细胞周期调控和细胞凋亡、蛋白质加工和囊泡转运以及 ECM 合成和组织
- 通路网络间性-中心性评分则表明表皮生长因子受体(EGFR)和雌激素信号转导是组织EV中关键的共同疾病驱动分子成分
组织EV的多组学网络分析发现EV中调节钙化的因子
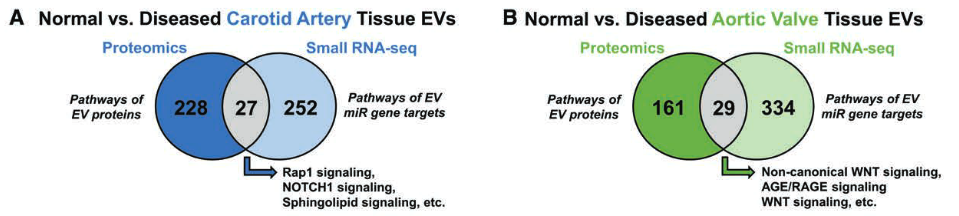
- 在完整的颈动脉或瓣膜中,随疾病改变的EV蛋白和EV miRs的基因靶标中分别富集了27条和29条重叠的通路。
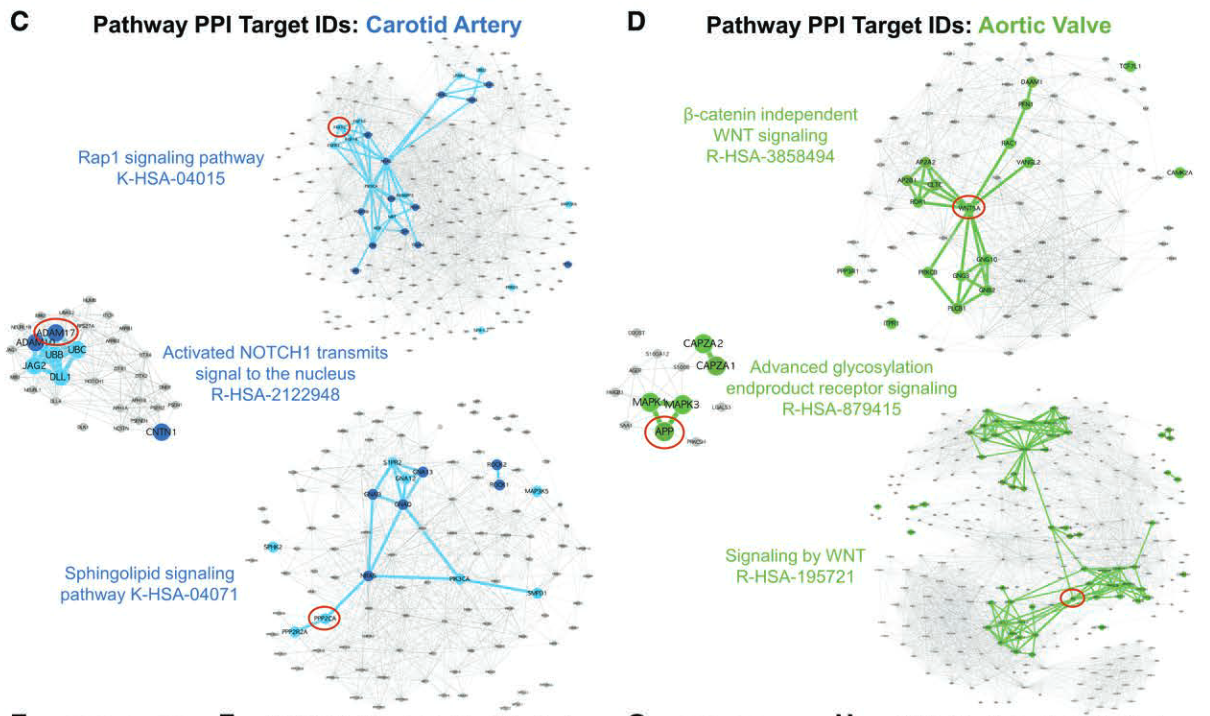
蛋白质-蛋白质相互作用网络,以评估那些有可靠文献证据表明参与钙化的重叠通路的综合效应。
- 颈动脉中:
- Notch
- FGFR2(成纤维细胞生长因子受体 2;通过 ERK/PKC 信号转导间充质干细胞成骨命运的关键介质)
- PPP2CA(蛋白磷酸酶 2 催化亚基α;间充质干细胞成骨/骨形成的 ERK/p38 依赖性调节因子)
- ADAM17(ADAM 金属肽酶结构域 17;成骨细胞中受 RUNX2 调节的 NOTCH 信号激活因子)
- 瓣膜中:
- WNT5A(Wnt 家族成员 5A;非规范 Wnt 介导的成骨 的控制者)
- APP(淀粉样β前体蛋白;在 AV 狭窄中发现的淀粉样斑块的基础,也是成骨细胞存活和骨形成的促进因子)
- APC(腺瘤性息肉病大肠杆菌 WNT 信号调节器;通过降解β-catenin 拮抗 Wnt 信号)。
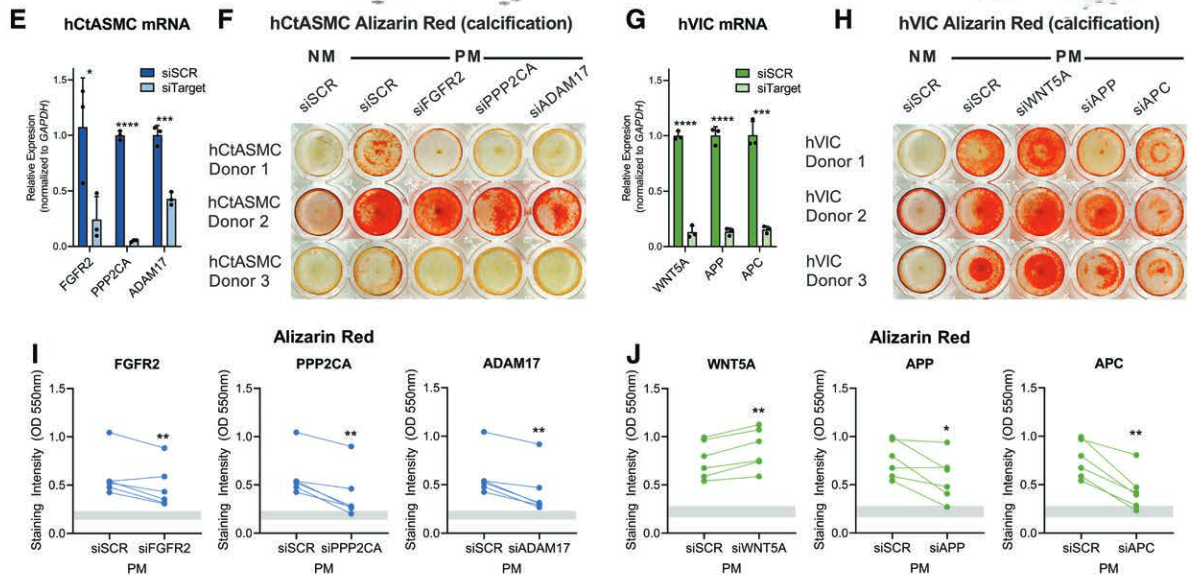
- 敲低的 FGFR2、PPP2CA 或 ADAM17 可显著减少在促钙化培养基中培养 14 至 21 天的原代人颈动脉 SMC(n=3 )的钙化。
- 敲低 WNT5A、APP 和 APC可明显减弱原代人主动脉瓣间质细胞(hVICs;n=3 )的钙化。
创新性
- 首次对人类颈动脉斑块和钙化主动脉瓣进行比较蛋白质组学研究,鉴定出动脉粥样硬化和主动脉瓣狭窄的独特驱动因素,并指出外泌体在进展性心血管钙化中的作用。我们描绘了一种囊泡组学策略,用于从纤维钙化组织中分离、纯化和研究外泌体中的蛋白质和RNA载体。通过网络方法将囊泡蛋白质组学和转录组学整合起来,揭示了组织外泌体在调节心血管疾病中的新角色。
- Vesiculomics 是一种高效、经济实惠、易于获得并且经过高度验证的策略,可用于直接从纤维钙化人体组织中分离、定量和评估EV蛋白负荷和小RNA,这种策略适用于其他疾病环境或动物/工程组织的评估。
- 多组学研究揭示了心血管组织EV的内容物在疾病进展过程中以特异性的方式受到调控;这些EV携带强效的调节剂对血管平滑肌和瓣膜间质细胞的钙化起到作用。
转化价值
- 尽管存在共同的风险因素和相似的疾病表型,抗脂质药物疗法未能改善主动脉瓣狭窄的结果。
- 探测组织EV为心血管疾病的精准治疗开辟了新途径。
- 以组织EV多组学为基础的网络医学方法发现治疗靶点是未来个体化血管和心脏瓣膜钙化治疗的有希望途径。
组内讨论
通过科学问题简要梳理文章逻辑
- 为什么要进行颈动脉斑块和主动脉瓣钙化的对比研究?(研究背景)
- 为什么聚焦到EVs?共有120种蛋白质具有相同的变化趋势。 该课题组前期的研究有一定基础。
- 如何分离纯化组织中的EVs?参考了体液/培养基中EVs的分离方法并结合蛋白组学改进,开创
Vesiculomics。 - 如何通过
Vesiculomics获得关键调控单元或者调控分子?多组学的差异分析,多策略的Venn图比较(多次取交集)。 - 如何验证这个方法的有效?体外细胞水平的初步验证。
对我们后续研究的一些提醒
- 多组学分析的重要性。
- 组织EV是一个值得开发的研究领域,但是其实验体系与我们目前的研究技术有较大差异,如果打算进行相关的研究需要长期的准备。
- 统计学方法。
© 版权声明
文章版权归作者所有,转载请注明来源。
THE END













暂无评论内容