“single-cell RNA seq”,“干细胞与转分化”。参与CAVD疾病驱动VICs亚群DDP-VICs(CD44^high^CD29^+^CD59^+^CD73^+^CD45^low^)
总结
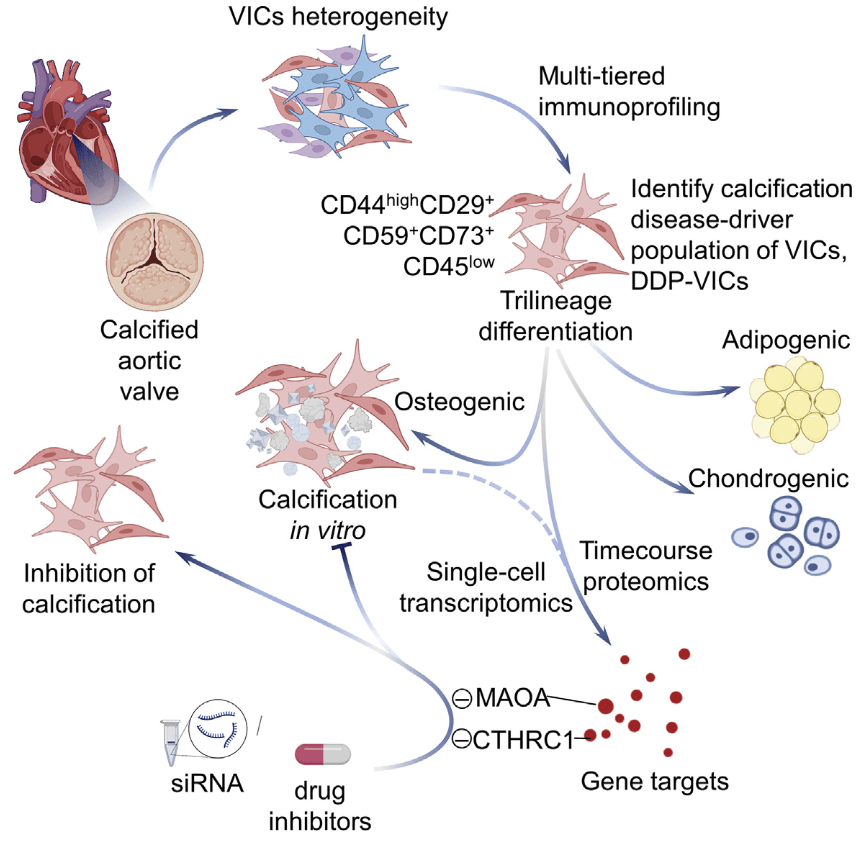
- 作者通过高通量流式检测鉴定出一个参与CAVD疾病驱动VICs亚群
DDP-VICs(CD44^high^CD29^+^CD59^+^CD73^+^CD45^low^) - 该亚群具有多向分化潜能(包括成骨、成软骨、成脂肪)
- 单细胞转录组分析结合蛋白质组学分析发现
MAOA和CTHRC1可能作为潜在的治疗靶点 - 体外实验证明了以上靶点的有效性
研究技术
- HTS-FC
- ?a tissue-spread technique IHC,与普通IHC相比能够更好的保存组织的3维结构
- 激光扫描共聚焦的三维重建
- 免疫组化的空间分析(有点类似于空间转录组学分析的形式)
- 多色免疫荧光(五标六色)
- CyTOF (一种蛋白质谱技术)
- 单细胞转录组测序
- 蛋白质组学分析
结果解读
MSCs和VICs的共有的细胞表面标记物
作者提出的假说认为主动脉瓣中存在一类祖细胞样VICs驱动钙化形成。

- 检测样本(4组)
- 8个CAVD手术标本
- 未分化MSCs(NM)
- 成脂诱导的MSCs(AM)
- 成骨诱导的MSCs(OM)
- 检测方法
- 是BD公司的一套细胞表面标记物流式单细胞检测方案,包含了242个细胞表面分子
- 本质上是运用了抗原抗体的结合,特异性高。与单细胞转录组测序(scRNA-seq)在原理上完全不同。

- 外圈的环形热图
- 242个细胞表面分子阳性细胞在4组样本中的比例分布
- 以CD44为例,热图上显示该分子在4行中的都很红,表明四组样本中CD44+的细胞比例均很高,进一步推测CD44是VICs中具有类似MSCs功能的祖细胞标记物之一。
- 圈内的PPI网络图
- 13个细胞表面分子(红点)
- 以上分子的近邻(黄点)
- 钙化相关分子(蓝点):osteocalcin, tissue-nonspecific alkaline phosphatase [ALPL], RUNX2, and osteonectin
- CD44的圈很大(与其互作的分子较多),说明其在网络中可能起到关键作用(hub node)
以下分子(16个)在四组细胞中均>85%细胞比例:CD13, CD29, CD44, CD47, CD49e, CD55, CD58, CD59, CD63, CD73, CD147, CD151, CD164, beta2-microtubulin, HLA A-B-C, and HLA-B2。而CD38和CD45则具有较大差异(这两个分子是典型的白细胞表面标记物)
CD44^+^VICs分布在主动脉瓣钙化区周围

- 对祖细胞、成骨、成纤维细胞标记物进行检测
- CD44 在F层的比例最高,而已知F层VICs具有更强的钙化潜能。进一步推测CD44^+^VICs的潜在功能。
CD44^high^VICs在功能和空间分布上均与钙化显著相关
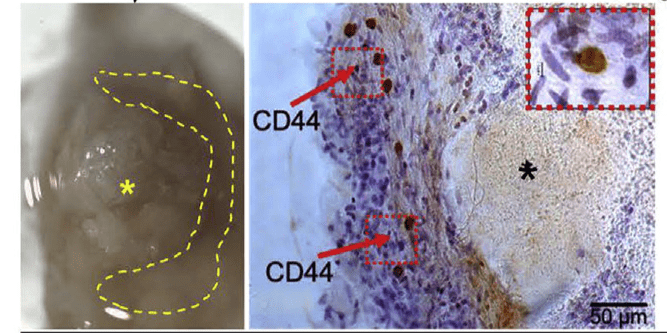
- IHC检测发现CD44^high^VICs大量分布在钙化区域周围
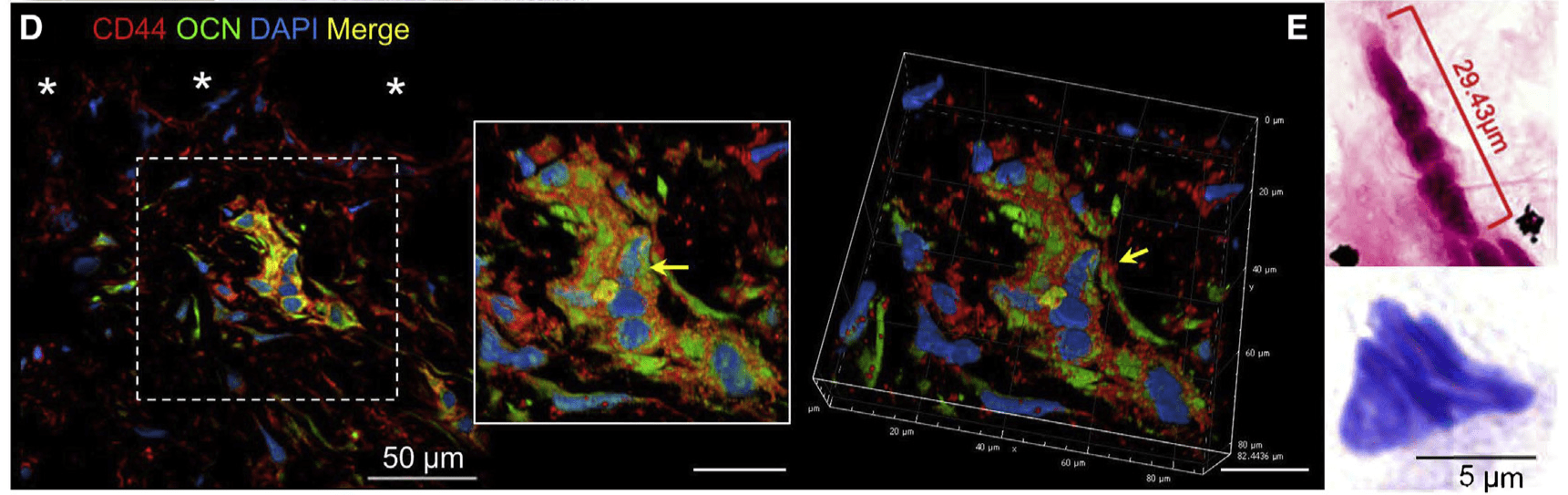
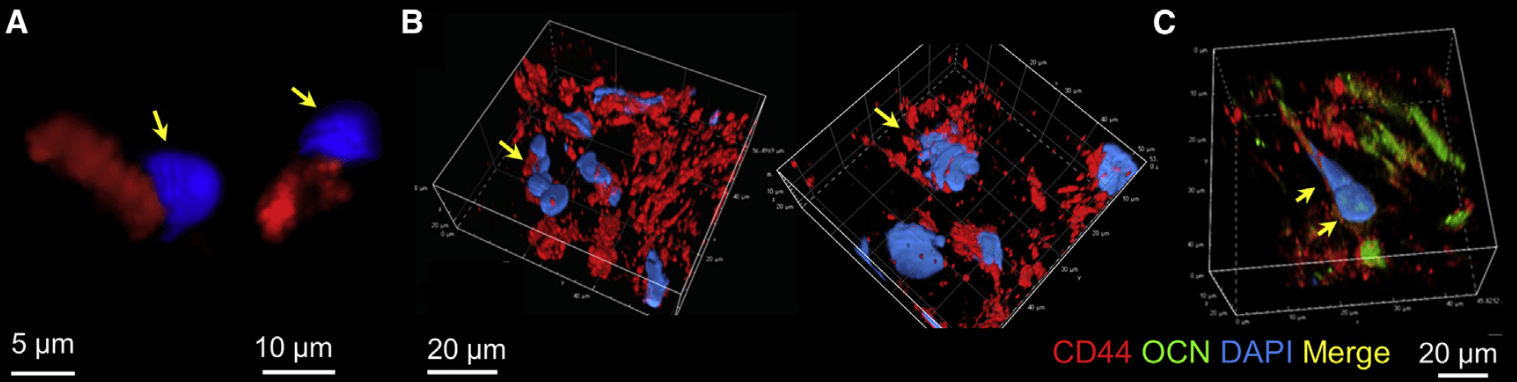
- 免疫荧光染色检测到CD44与OCN的共表达(激光共聚焦拍摄,z轴扫描,三维重建)
- CD44与OCN共表达细胞的核形态不规则,这些细胞核多为串珠状或铃铛状(bell shaped),与胚胎发育过程中的代核祖细胞(metakaryotic)非常相似。(Gostjeva et al., 2009).
- 进一步推测其也具有祖细胞特性。
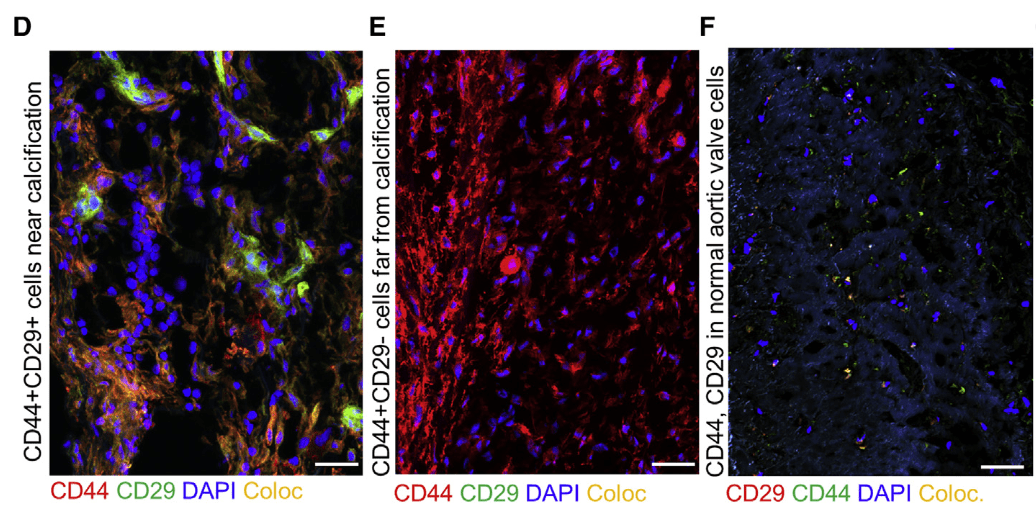
- CD44^+^CD29^+^细胞多分布在钙化区域附近(CD29是祖细胞标记物之一)
- CD44^+^CD29^-^细胞离钙化区域较远
- 正常主动脉瓣中CD44^+^与CD29^+^细胞均较少
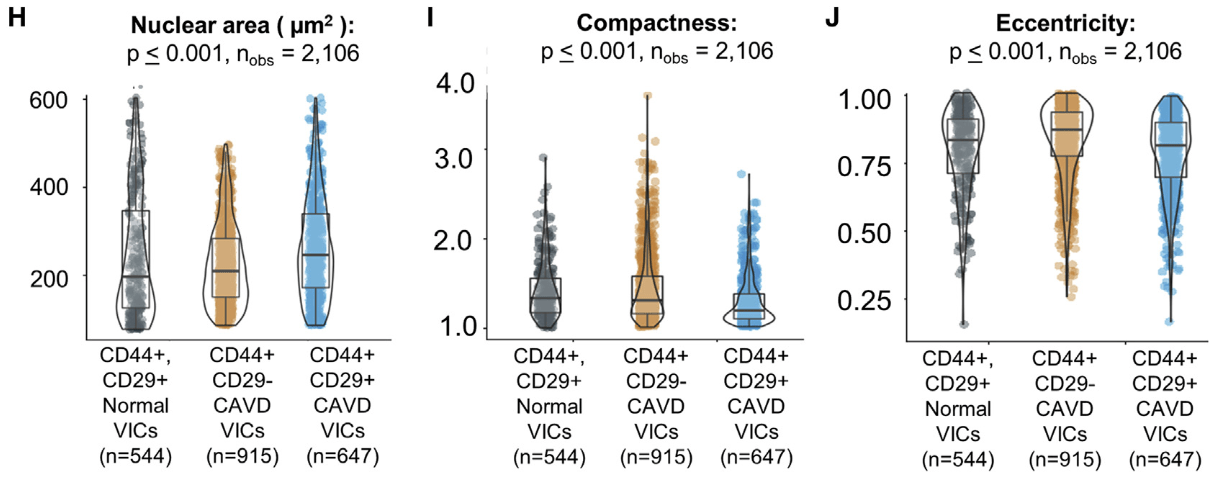
- 参数:

- 祖细胞样VICs(CD44^+^CD29^+^细胞)的细胞核倾向于更大,而且异质性更高,可能与染色质活动的变化相关。
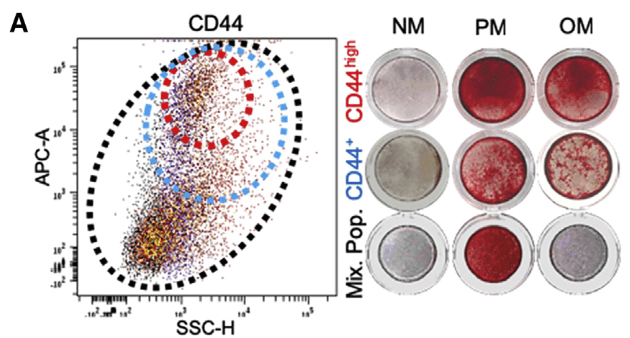
- 流式分选组织中的CD44^high^与CD44^+^细胞,分别用于促钙化/成骨分化培养。CD44^high^细胞的钙化潜能更高,CD44^+^次之,混合细胞钙化潜能弱。
- PM:高磷酸盐促钙化培养基
OM:成骨分化诱导培养基 - 补充验证
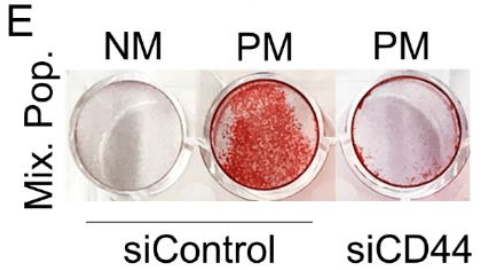
- MIX VICs在PM中能够产生钙化,为了证明是由于混合的VICs中CD44+细胞引起的,使用siRNA敲低CD44后,钙化潜能降低。

- MIX VICs在PM中能够产生钙化,为了证明是由于混合的VICs中CD44+细胞引起的,使用siRNA敲低CD44后,钙化潜能降低。
成骨样CD44^high^VICs同时表达CD29, CD59, CD73祖细胞标记物
作者定义了主动脉瓣中的成骨样祖细胞为 CD44^high^CD29^+^CD59^+^CD73^+^CD45^low^VICs
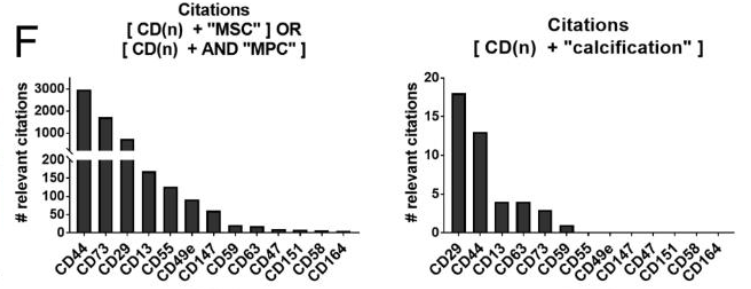
- 作者根据图1中HTS-FC找到的13个细胞表面分子,进一步通过文献检索,识别到CD44, CD73, CD29, CD13, CD55, CD49e, CD147, and CD59等分子是引用较多的MSCs标记物。
- 而与钙化相关的CD分子有:CD29, CD44, CD13, CD63, CD73, CD59, CD55, and CD49e
- 两者的交集:CD44, CD29, CD13, CD73, CD55, CD59, and CD49e
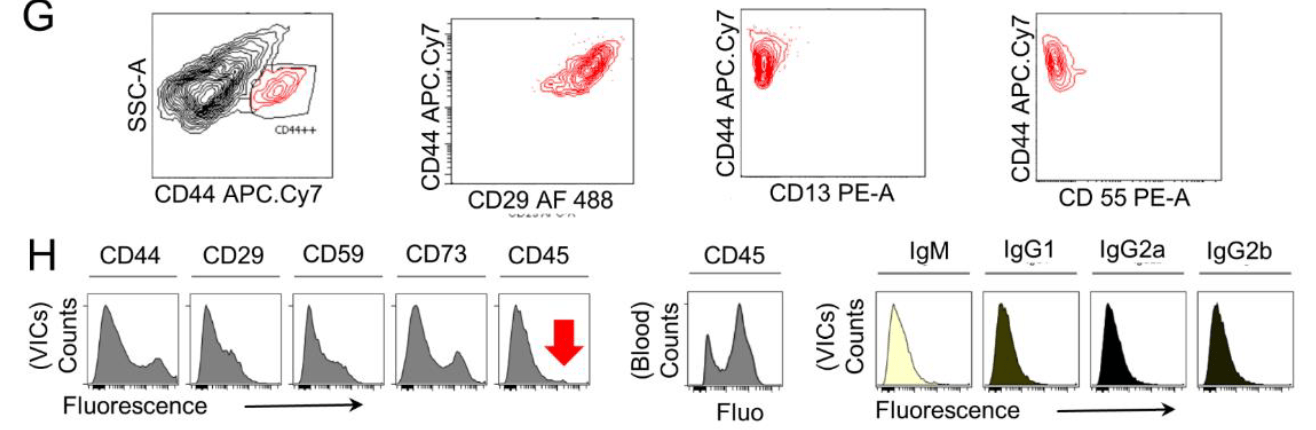
- 检测以上分子的共表达:发现在CD44^high^VICs中存在CD29、CD59、CD73的表达,而几乎没有CD13、CD55的表达
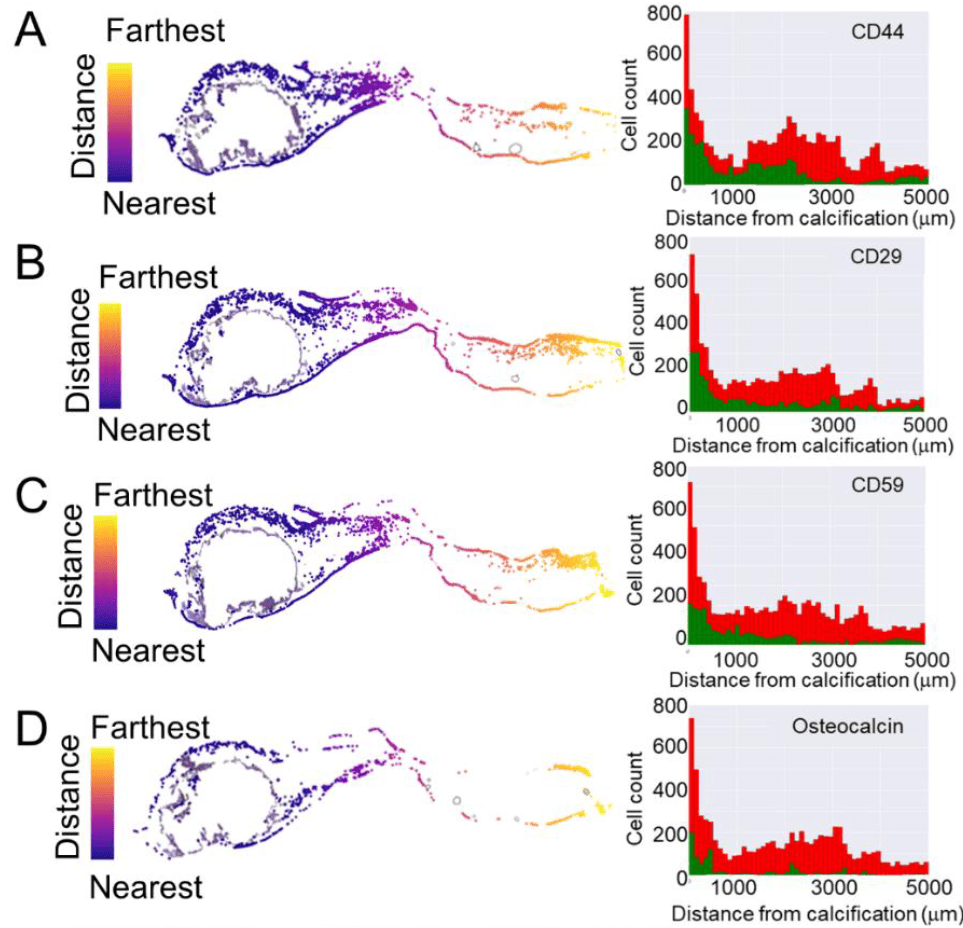
- 分别分析IHC中CD44、CD29、CD59和OCN阳性细胞的空间分布情况,发现均在钙化周围分布较高,而远离钙化的区域降低
- 至此,将成骨样祖细胞定义为CD44^high^CD29^+^CD59^+^CD73^+^CD45^low^VICs
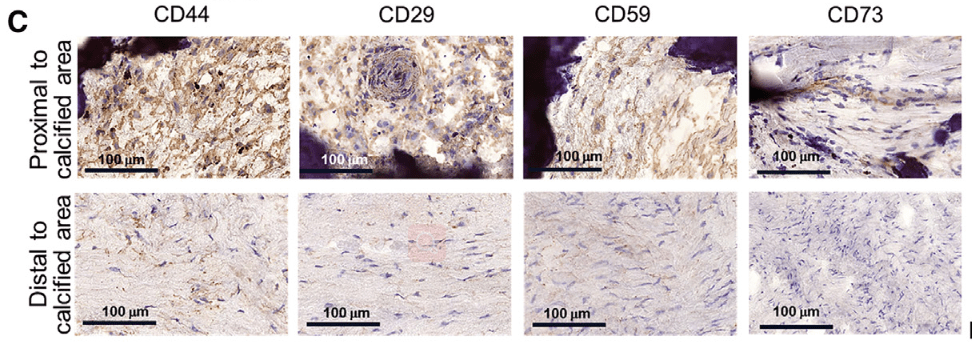
- CD73
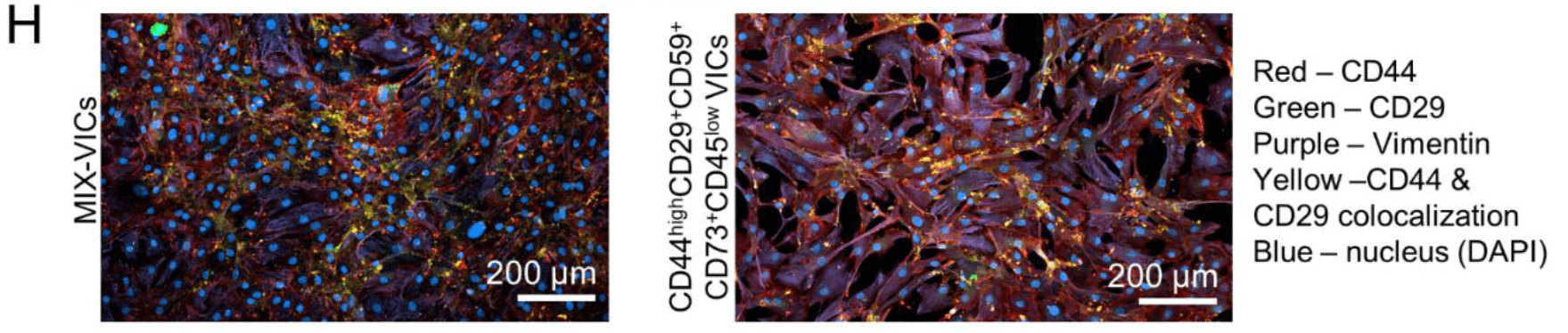
- 体外培养的VICs:MIX vs Progenitors
- 多色免疫荧光(五标六色)
CD44^high^CD29^+^CD59^+^CD73^+^CD45^low^VICs在体外培养中具有多向分化潜能
将CAVD标本分选得到的CD44^high^CD29^+^CD59^+^CD73^+^CD45^low^VICs命名为DDP-VICs(Disease Driver Population),未分选的混合VICs称为MIX-VICs
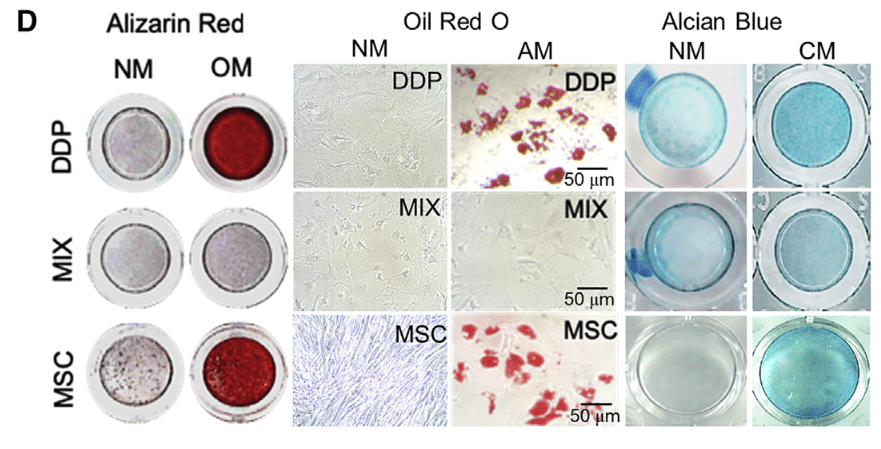
- DDP具有与MSCs相似的多向分化潜能
- Alizarin Red:成骨/钙化
- Oil Red O:脂肪
- Alcian Blue:软骨
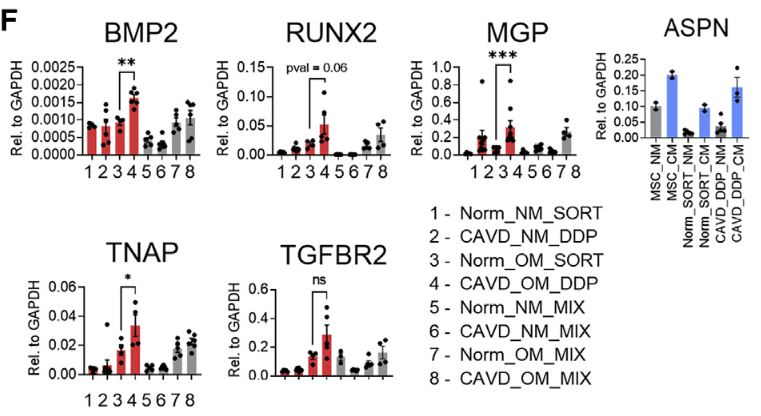
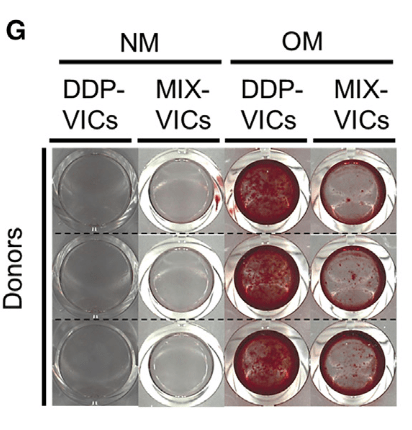
- qPCR相对定量
- DDP在OM中培养后成骨相关的基因明显高于其他组
- 钙化能力显著高于MIX
CyTOF进一步验证DDP的祖细胞表型
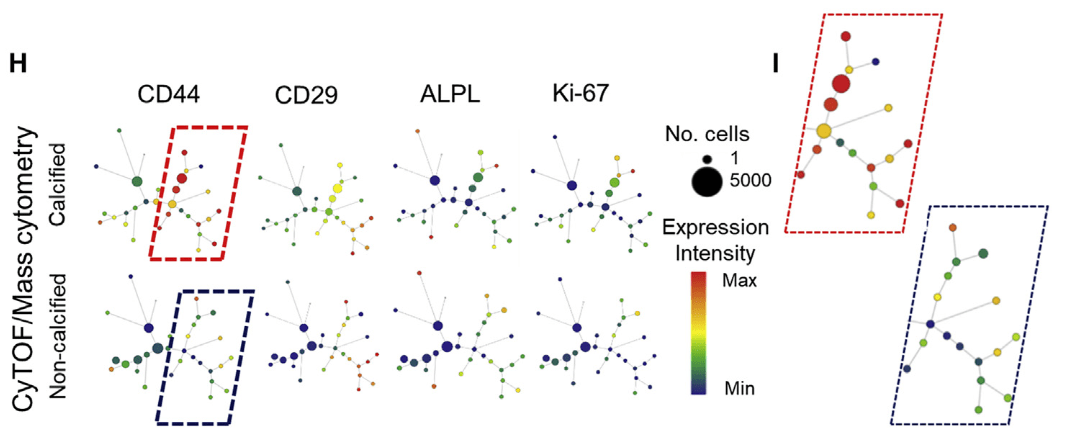
- SPADE可视化生成的细胞聚类图谱(一个点表示一个cluster)
- 框出来的区域展示了CD44高表达的细胞
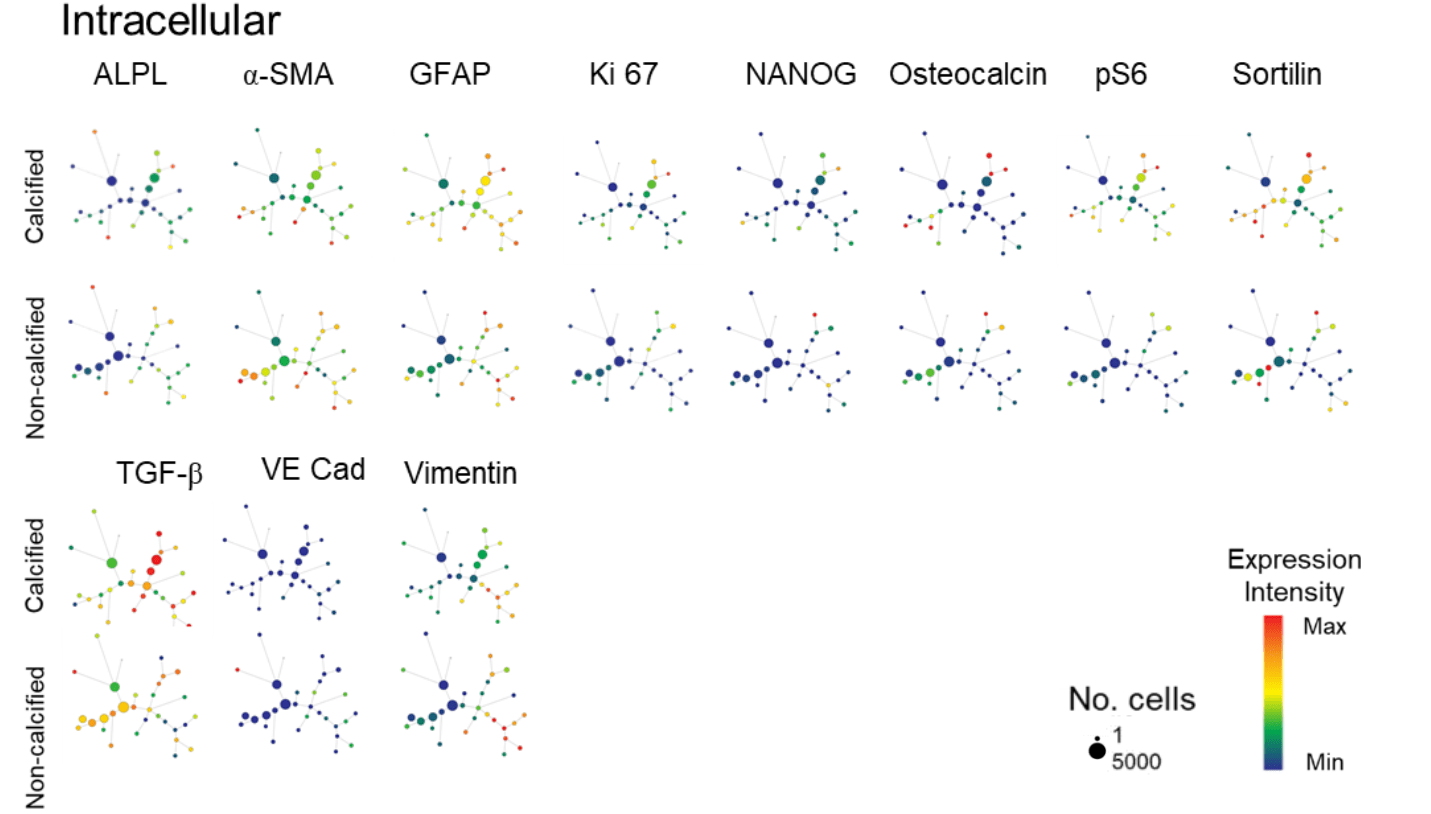
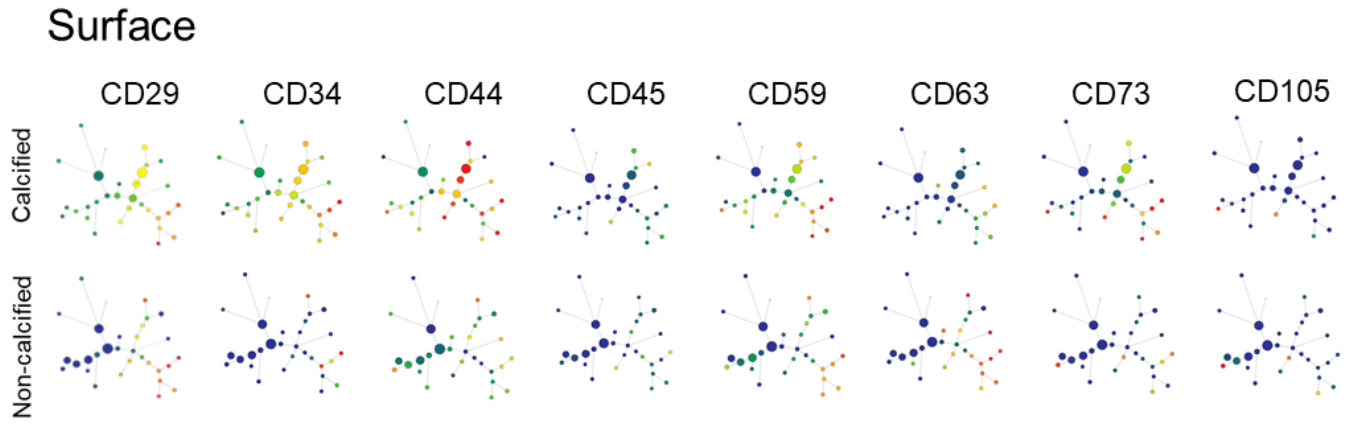
- 成骨、增殖、祖细胞等标记物均在DDP区域表达高,且阳性细胞比例多
单细胞转录组测序鉴定DDP成骨分化过程中的高表达基因
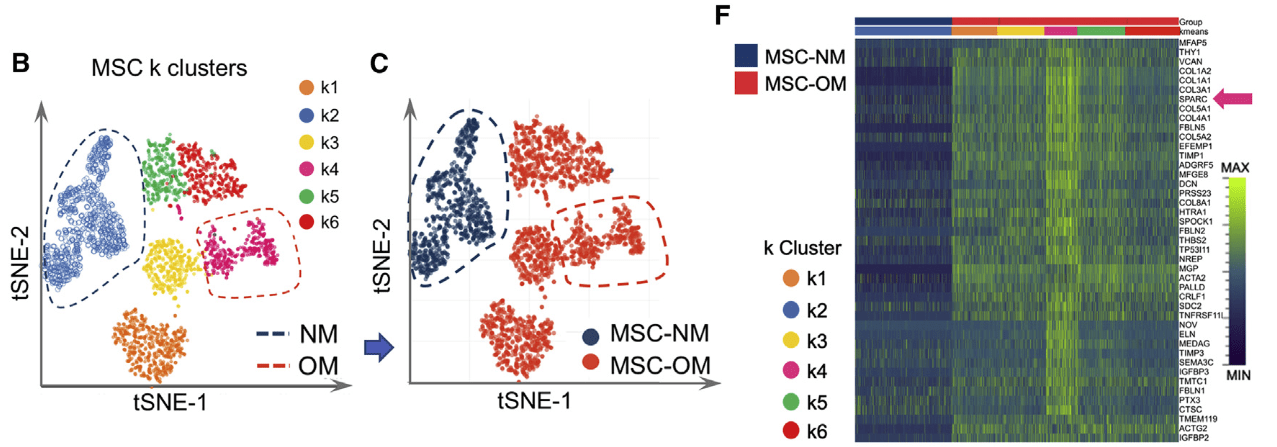
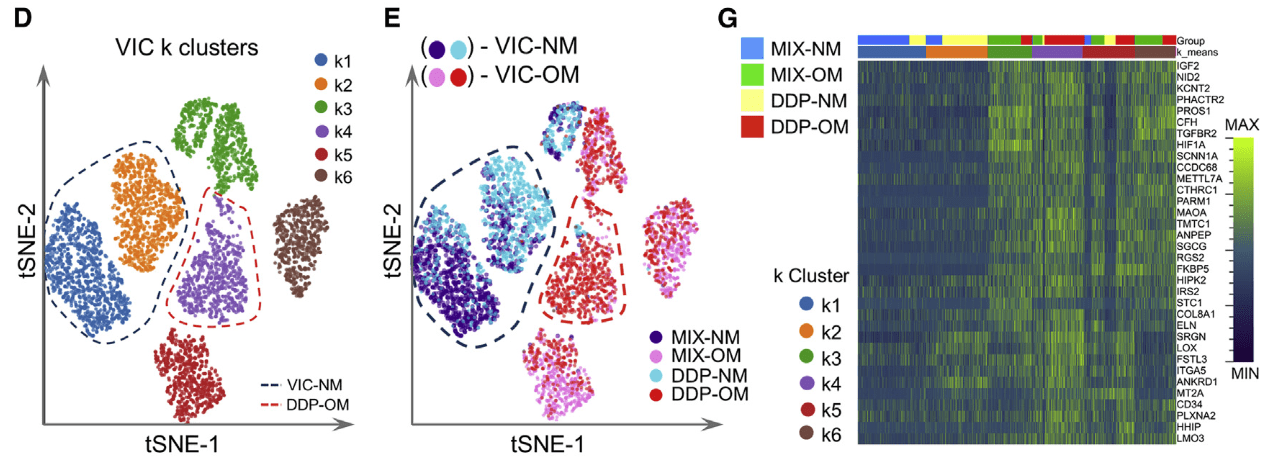
- tSNE降维
- MSCs在OM培养后表现出更高的异质性(分出了5个亚群),而在NM中维持一个亚群k2.(B、C)。但是OM组与NM组没有细胞重合。
- VICs的情况与MSCs相似,但混合程度更高一些。VIC-NM和VIC-OM均是DDP组与MIX组的混合
- 基因表达热图
- 展示了各亚群基因表达的变化,SPARC(成骨标记物)在OM组中高表达,尤其是k4亚群。其余升高的基因包括osteoprotegerin (osteoclastogenesis inhibitory factor/
TNFRSF11B), osteonectin (SPARC),SPOCK1,elastin,Thy-1 (CD90), and several collagen-related proteins (CTHRC1,COL1A1,COL1A2,COL3A1,COL4A1,COL5A1, andCOL5A2)等 - VICs中k4亚群也是具有最高的成骨活动,与MSCs的k4相似,而这个k4亚群主要由DDP-OM构成。高表达基因包括
MAOA,PHACTR2,TGFRB2,HIF-1A,elastin, and collagen regulation-associated proteins (COL8A1, lysyl oxidase,CTHRC1).
- 展示了各亚群基因表达的变化,SPARC(成骨标记物)在OM组中高表达,尤其是k4亚群。其余升高的基因包括osteoprotegerin (osteoclastogenesis inhibitory factor/
蛋白质组学分析
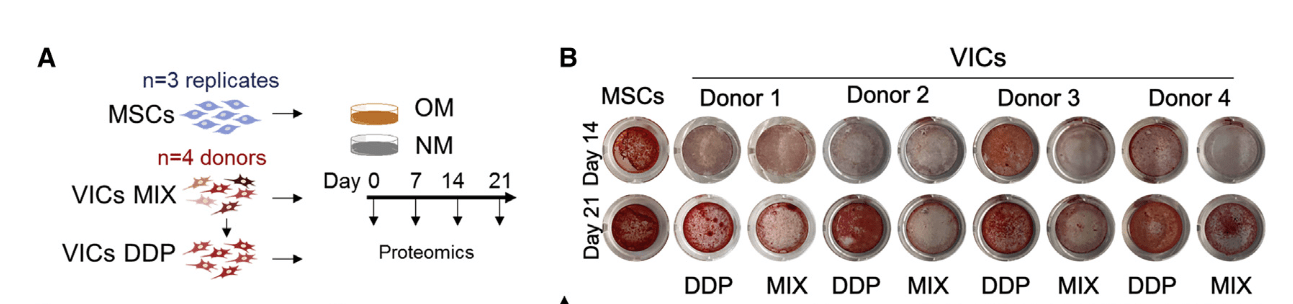
- 4例样本分选出DDP和MIX组,分别进行OM培养(以MSCs作为对照),然后进行总蛋白质谱检测
- DDP的成骨分化潜能更高
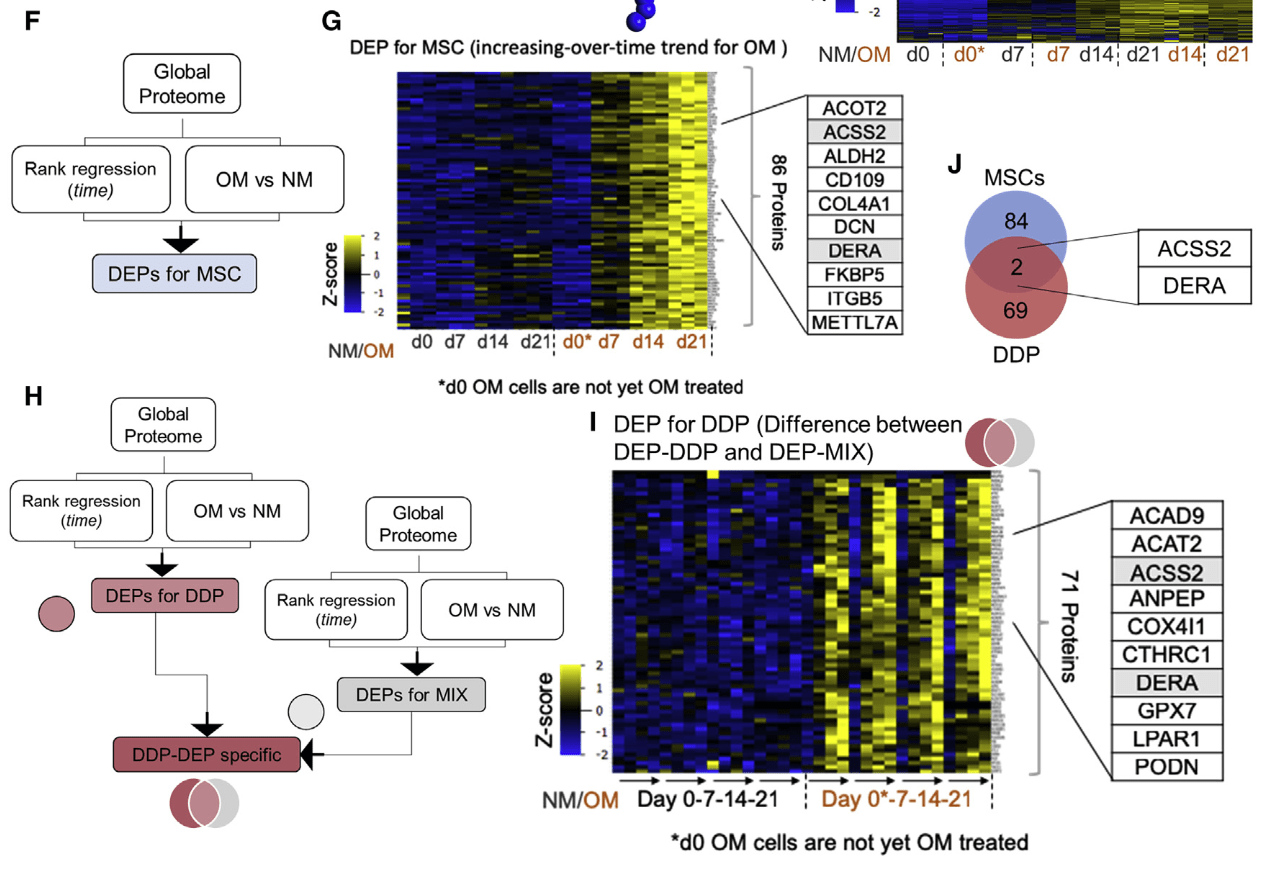
CTHRC1和MAOA促进了DDP-VICs的钙化
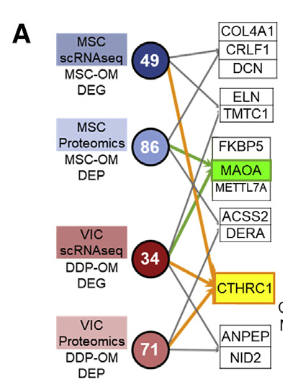
单细胞转录组得到的差异基因和蛋白质组学得到的差异蛋白取交集,识别到CTHRC1和MAOA
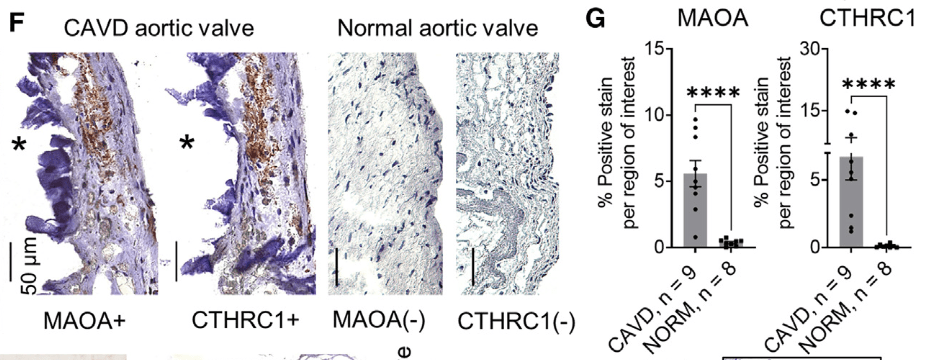
免疫组化验证这两个分子在钙化瓣膜高表达
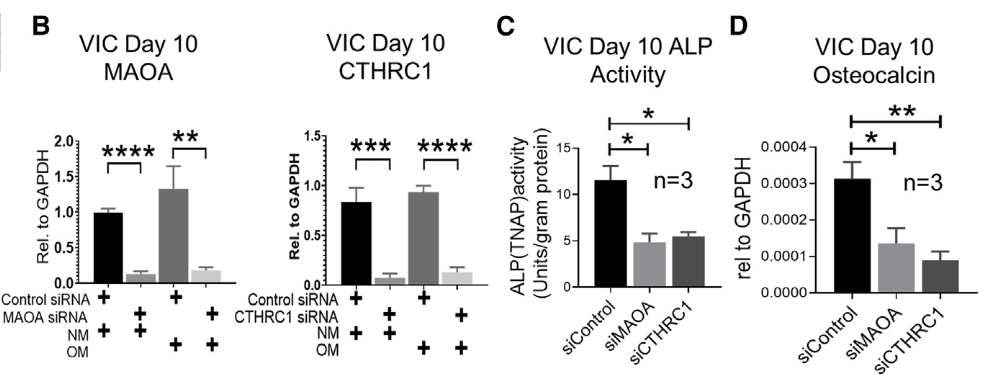
体外敲低CTHRC1和MAOA能够抑制VICs钙化
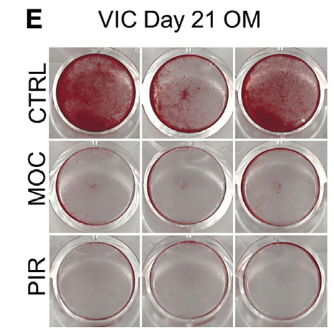
- MAOA的小分子抑制剂moclobemide和pirindole也能够抑制VICs钙化
- 目前还没有
CTHRC1的小分子抑制剂
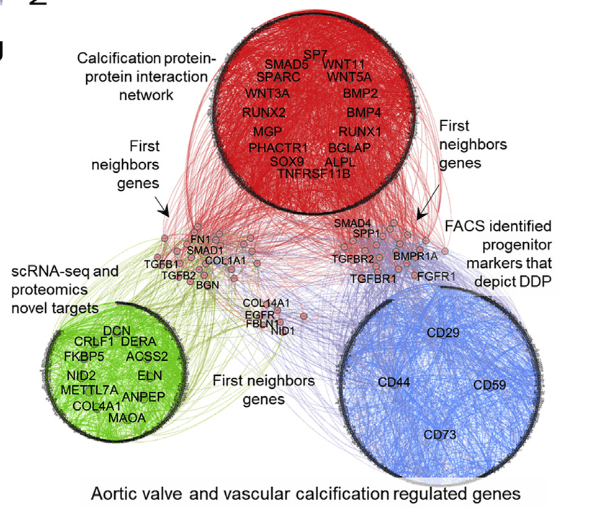
钙化相关疾病蛋白互作网络与DDP-VICs中共有的差异基因/通路
© 版权声明
文章版权归作者所有,转载请注明来源。
THE END












暂无评论内容