主动脉瓣组织学分层蛋白组学图谱
Spatiotemporal Multi-Omics Mapping Generates a Molecular Atlas of the Aortic Valve and Reveals Networks Driving Disease
背景知识
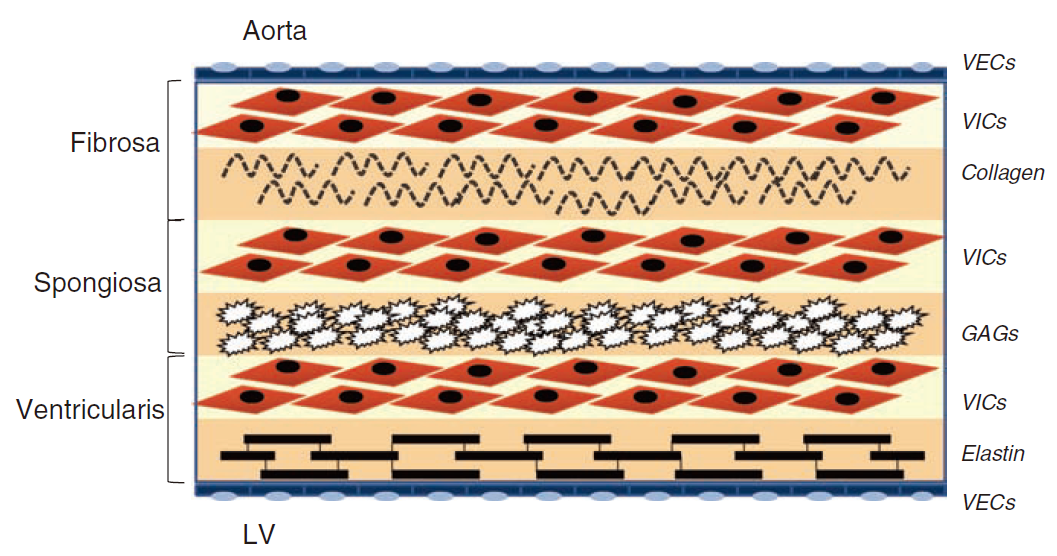
主动脉瓣的结构分三层:面向主动脉的一层富含胶原纤维,中间是富含粘多糖的间质层,内层面向心室富含弹力纤维。
钙化的发生是从瓣膜的纤维膜一侧,附着在主动脉管壁的基底部位开始,向瓣膜的尖端进展的。疾病进展的不同阶段形态分明,在一个单独的钙化瓣膜上可以同时存在正常区域、纤维化区域和钙化区域。
在健康的瓣膜中,瓣膜间质细胞主要是维持瓣膜稳态和正常生理功能的静止的成纤维细胞构成,在病理条件刺激下,VICs向肌纤维母细胞和成骨细胞分化,导致细胞外基质重塑,瓣膜纤维化、变硬、钙质沉积。
从组织学的角度来讲,主动脉瓣组织的结构本身是对血流动力学的一种主动的适应。主动脉瓣的细胞外基质可以分为三层,分别是位于主动脉侧的纤维层、位于左心室侧的弹力蛋白层和二者之间的疏松层。
三层的分布以及组织结构很好地适应了血流动力的需要。在收缩期,血流由左心室流向主动脉,血流的剪切力作用于主动脉瓣的心室侧,心室侧的弹力蛋白被拉伸,而主动脉侧的纤维收缩,使主动脉侧皱缩,瓣膜开放;而在舒张期,心室侧的血流剪切力减弱,血液作用于主动脉侧,心室侧弹力蛋白回缩,主动脉侧的纤维回复,主动脉瓣关闭。在整个过程中,位于中间的疏松层起到对血液剪切力以及其引起的瓣膜相对运动的缓冲作用,并且其内的亲水性的氨基聚糖能够稳定地吸收水分,保证瓣膜组织能够抵抗渗透压而不会肿胀。
瓣膜内皮细胞在钙化性主动脉瓣疾病发病过程中的作用研究现状.pdf
本文重点数据
不同病变分期的组学研究
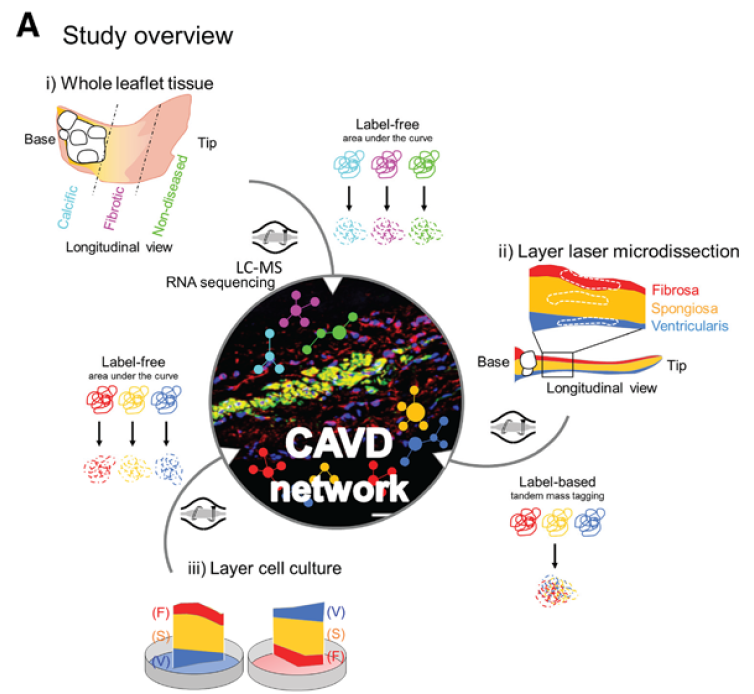
- 通过分子显像将整个钙化的瓣膜组织分成三个区域:钙化区、纤维化区和正常区,分别做转录组学和非标蛋白组学检测
- 瓣膜解剖分层(激光显微切割),做基于标签的蛋白组学检测
- 分层的VICs迁移培养,做非标蛋白组学检测
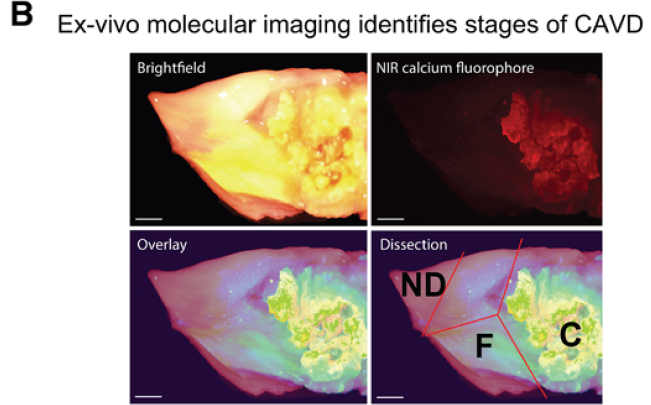
将钙化的主动脉瓣通过近红外荧光钙示踪分离成三个部分,交界区排除在外
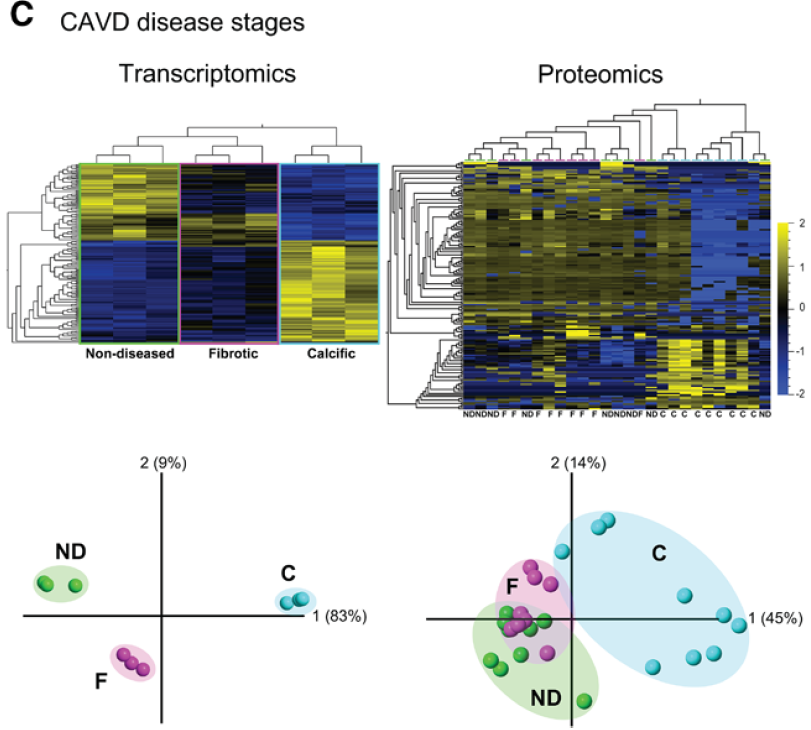
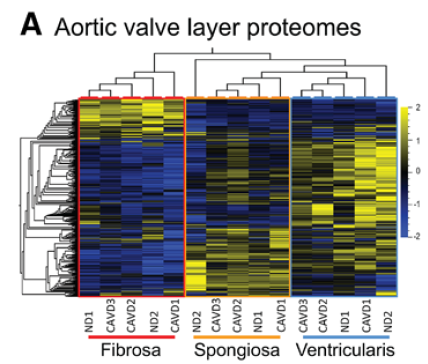
三个阶段分区转录组和蛋白组热图及主要成分分析。
转录组3×3个样本,蛋白组9×3个样本。
转录组与蛋白组不同区域高表达基因数量,以及共同高表达的基因名称

CAVD不同阶段的组学特征
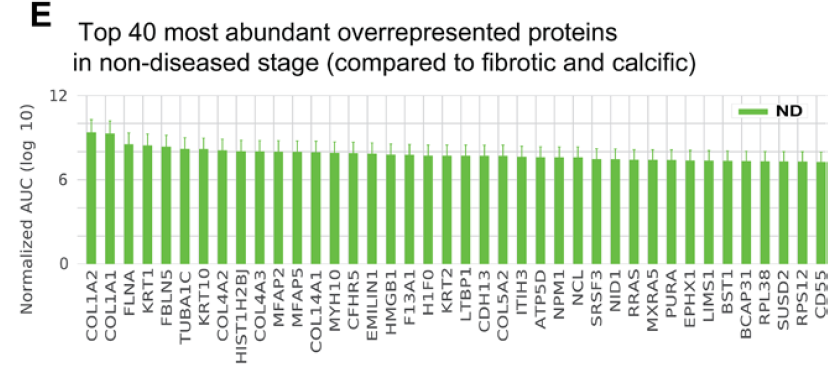
正常瓣膜中的蛋白以稳态胶原为主 COL1A2, COL1A1, COL4A2, COL4A3, COL4A1, COL5A2, COL6A6, COL6A3
纤维化期的瓣膜中检测的高表达表型及基因主要包括:VICs向肌成纤维细胞分化(MYH11、TAGLN2),氧化应激(SOD3),磷脂酶家族成员(PLA2G2A),钙化抑制剂(MGP),高亮氨酸残基小蛋白聚糖家族成员(BGN, DCN and OGN;文献表明其可以与氧化磷脂和病理性生长因子结合)
在纤维化期的转录组数据中,可见CLU, PCOLCE2, and GFAP 以及 CILP, PRG4, and CRTAC 高表达,表明这一阶段的细胞中含有软骨细胞,与蛋白组中显示的蛋白聚糖高表达一致。
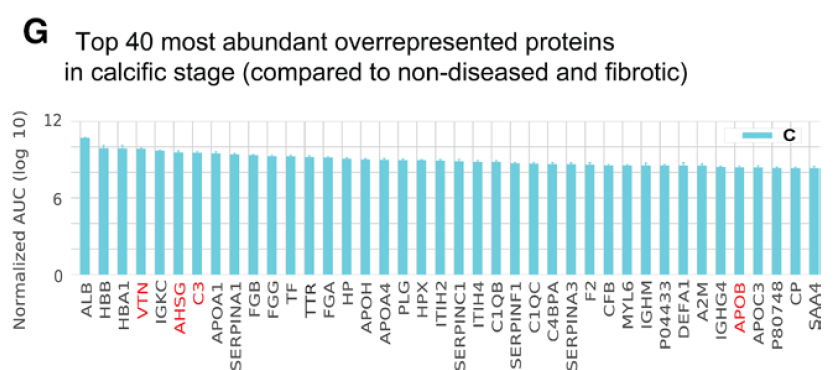
钙化期的蛋白中可见 vitronectin 和 fibronectin-1 的高表达,同时可见钙化相关的蛋白(TGM2, fetuin A [AHSG] and tissue-nonspecific alkaline phosphatase [ALPL]),炎症标记物(CRP),以及促炎载脂蛋白(APOB, APO(a) [LPA])增高。
除此以外,还有两类蛋白家族在钙化期表达增高:补体系统(C1QB, C1QC, C1R, C1S, C3, C4A, C4B, C5, C6, C7, C8A, C8G, CFB, CFD, CFHR2, CFHR4, CFI)和serpin(SERPINA1, A3, A4, A6, A7, A10, C1, D1, E1, F1, F2, and G1)蛋白家族。
瓣膜结构分层蛋白组学
用显微切割的方法将瓣叶的三层结构分离,分别做蛋白组检测。
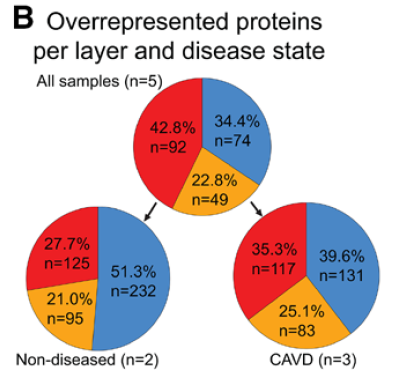
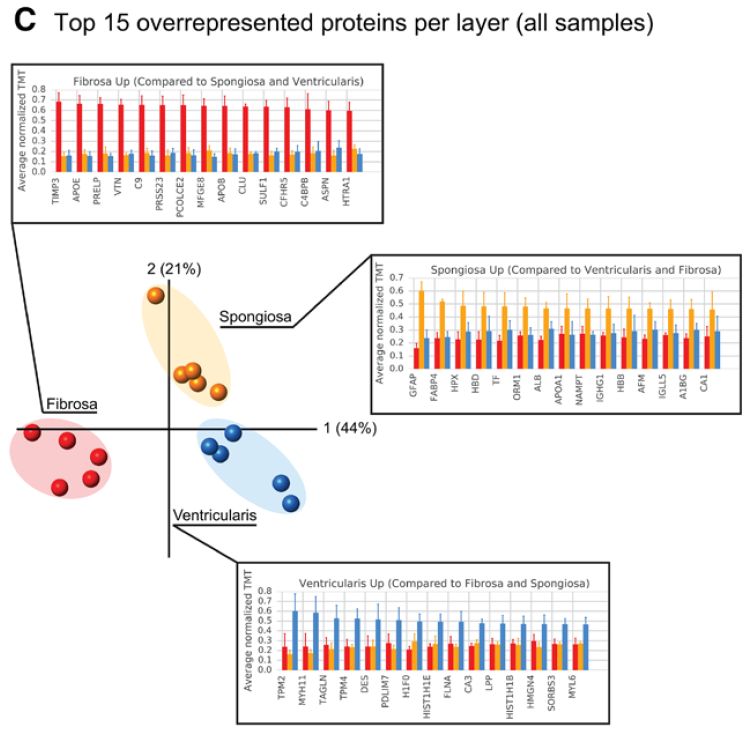
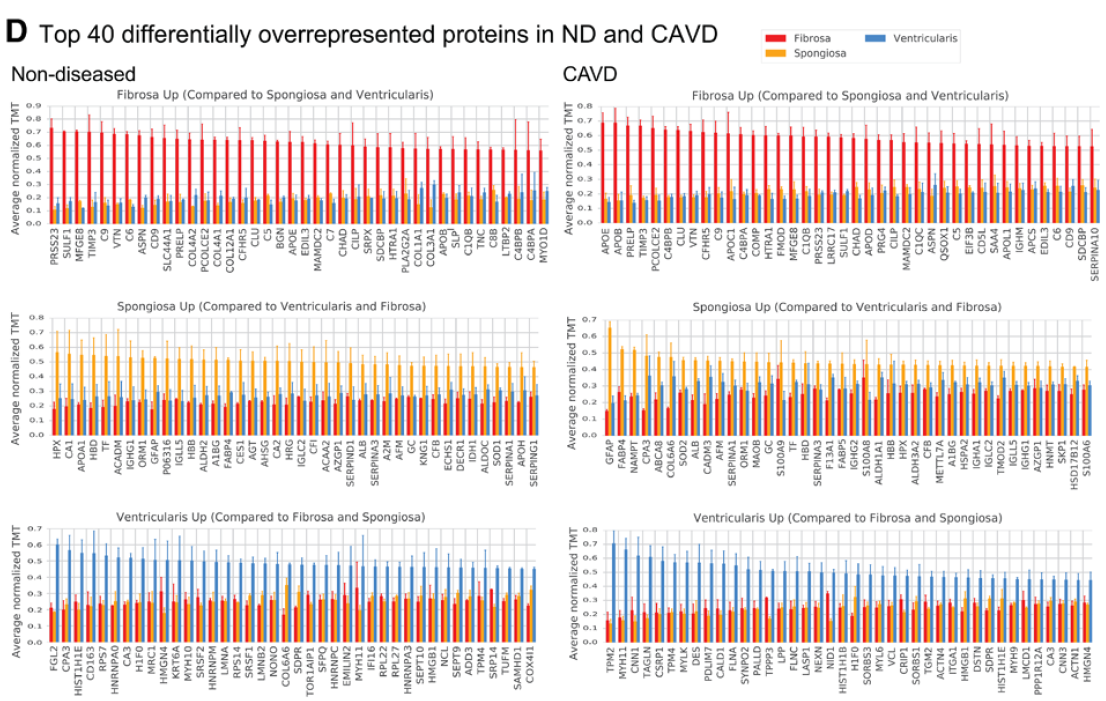

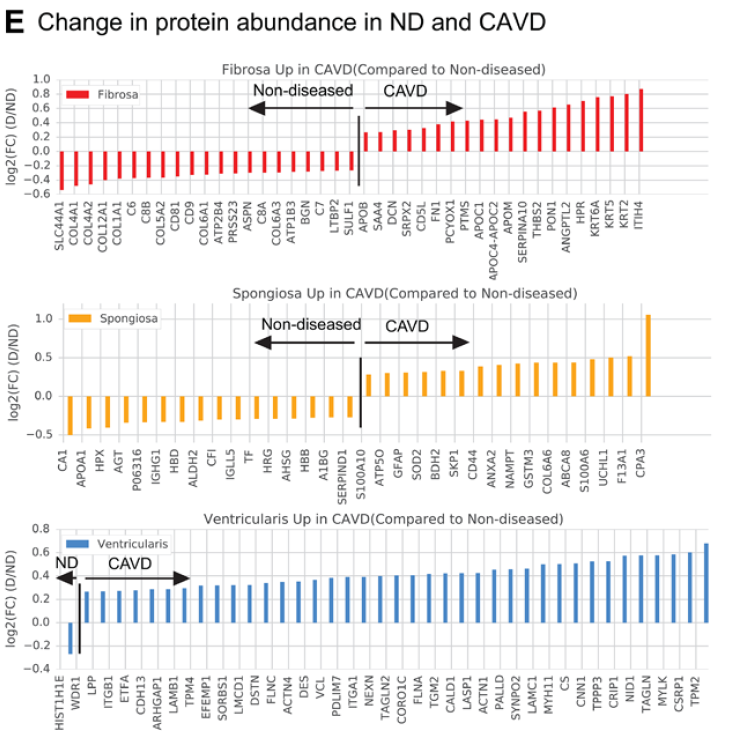
瓣膜分层蛋白组学特征
fibrosa 中 TIMP3, APOE, PRELP, VTN, C9, PRSS23, PCOLCE2, MFGE8, APOB, CLU, SULF1, CFHR5, C4BP8, ASPN, and HTRA1 高表达。病变瓣膜的 DCN, APOB, APOM, APOC1, FN1, ANGPTL2, and PON1 表达增高。
spongiosa 中 GFAP 以及脂肪细胞marker FABP4 高表达。病变瓣膜的GFAP 表达更高。
ventricularis 中有大量肌成纤维细胞活化的指标,病变瓣膜中更显著(TPM2, MYH11, TAGLN, TPM4, and MYL6)
CAVD瓣膜fibrosa层有大量载脂蛋白,如 APOE 的表达,而 ventricularis 层则表现为肌成纤维细胞显著激活。
CAVD疾病相关信号通路富集分析
疾病进展主要标志:平滑肌细胞激活、炎症、钙化相关通路
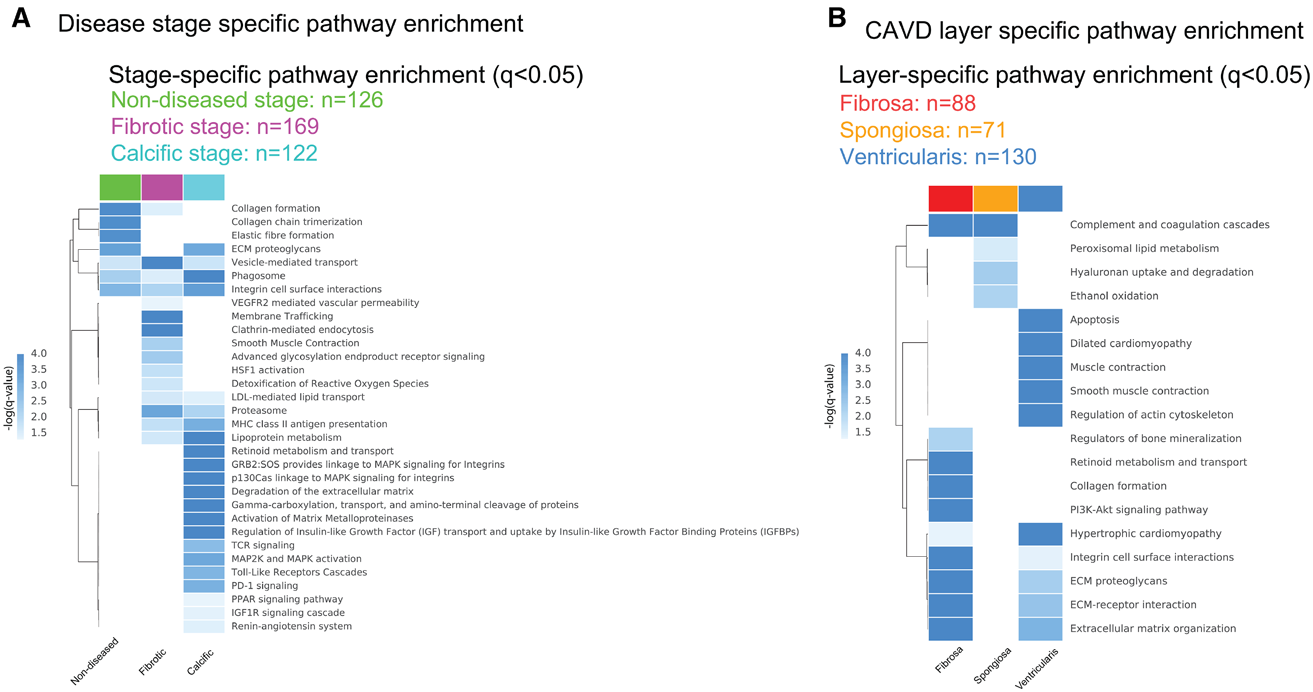

钙化期瓣膜主要通路:
- MAPK signaling
- lipid metabolism
- coagulation
- complement system
- inflammation
- ECM
病变瓣膜的 fibrosa层 高表达蛋白主要与钙化与纤维化通路有关
由于钙化首先发生在fibrosa层,故推测钙化期瓣膜中富集通路应该与病变瓣膜fibrosa层结果相似。
fibrosa层富集的通路主要有:
- integrin cell surface interactions
- PI3K (phosphatidylinositol-3-kinase)/Akt signaling pathway
- retinoid metabolism and transport
- regulators of bone mineralization
此外,与钙化期瓣膜一致富集通路如下:
- coagulation
- complement pathways
- lipoprotein and ECM-related pathways
钙化期瓣膜其他的明显差异通路

supplemental table 3
VICs迁移培养后细胞蛋白组学分析
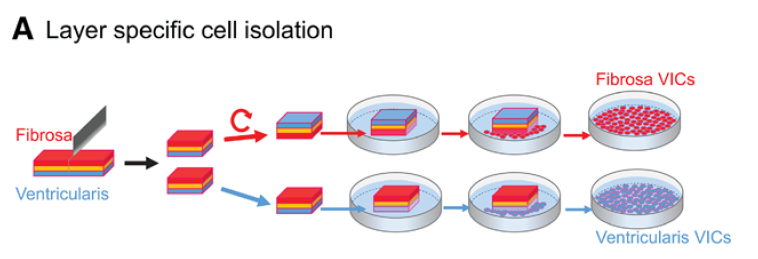
目前认为VICs成骨分化是导致瓣膜钙化的主要原因,并且发现钙化最早发生在fibrosa层,作者猜测不同部位的VIC可能具有不同的钙化潜能,故使用迁移培养的方式分离不同层的VIC进行研究。

fibrosa层的细胞在成骨分化培养和促钙化培养中表现出更强的钙化潜能
钙化的检测是通过Alizarin Red 染色后进行定量分析
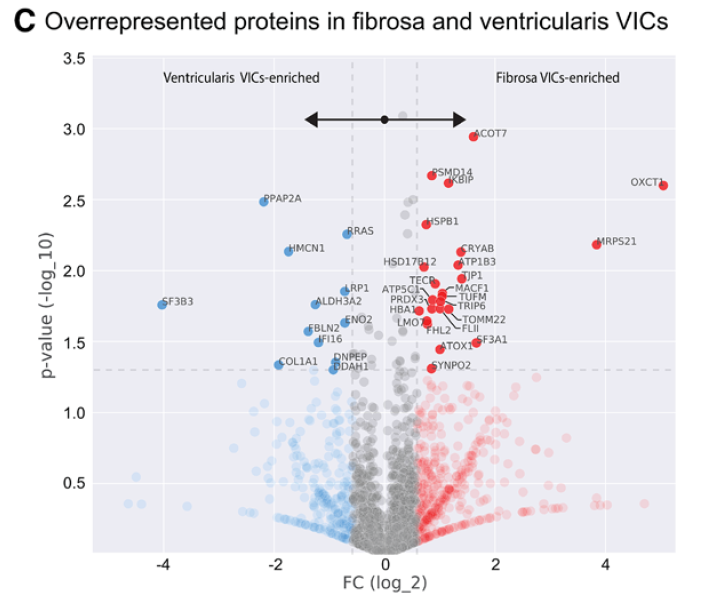
作者认为两层细胞的钙化潜能差异的本质在于两层细胞本身的蛋白组特征不同。故做了两层细胞蛋白组学分析火山图。
Ventricularis中高表达的主要是糖酵解、糖异生、和ECM重塑相关的基因,而Fibrosa中高表达的涉及线粒体、脂肪酸、酮体代谢相关通路:
















暂无评论内容