标题: Sexual Dimorphism of Plasma and Tissue Proteomes in Human Calcific Aortic Valve Stenosis Pathogenesis
期刊:Arteriosclerosis, Thrombosis, and Vascular Biology
引言
- 钙化性主动脉瓣狭窄 (AS) 是一个日益严重的全球性临床负担,影响着超过65岁人口的约2%。
- 目前,尚无有效的药物疗法,唯一可行的干预措施是外科修复和经导管瓣膜置换。
- **女性AS外科干预通常较延迟;HYHA心功能分级更差;术后结果比男性更差。**PMID: 35175844 (该引文中讲述的理由是:许多奠定指南推荐基础的标志性研究中,瓣膜性心脏病女性患者的代表性不足)
- 已有研究表明,女性AS患者表现出低钙化/高纤维化的组织学特征,且通常症状更重。
- 基于这些观察,本研究提出假设,即导致AS疾病进展和纤维钙化的潜在分子机制在男性和女性患者之间存在差异。本研究的目标是利用人AS队列蛋白质组学数据集,探索性别差异和潜在的性别特异性疾病特征。
本文的主要研究结果
本研究通过质谱(LC-MS/ms)蛋白质组学和定量组织病理学对人AS组织和血浆样本进行了深入分析,以揭示AS发病机制中的性别二态性。
血浆蛋白质组的性别差异
- 样本和方法: 对一个年龄、种族和AS严重程度匹配的临床队列(32名男性和20名女性)的血浆样本进行了LC-MS/ms蛋白质组学分析,识别循环中的性别特异性生物标志物。血浆样本使用PreOmics的iST-BCT试剂盒制备,肽段在Orbitrap Fusion Lumos质谱仪上分离和分析。MS/ms数据通过Proteome Discoverer软件包与人UniProt数据库进行比对,并通过Perseus v2.0.11进行Log2转换、Z评分标准化和差异富集分析。
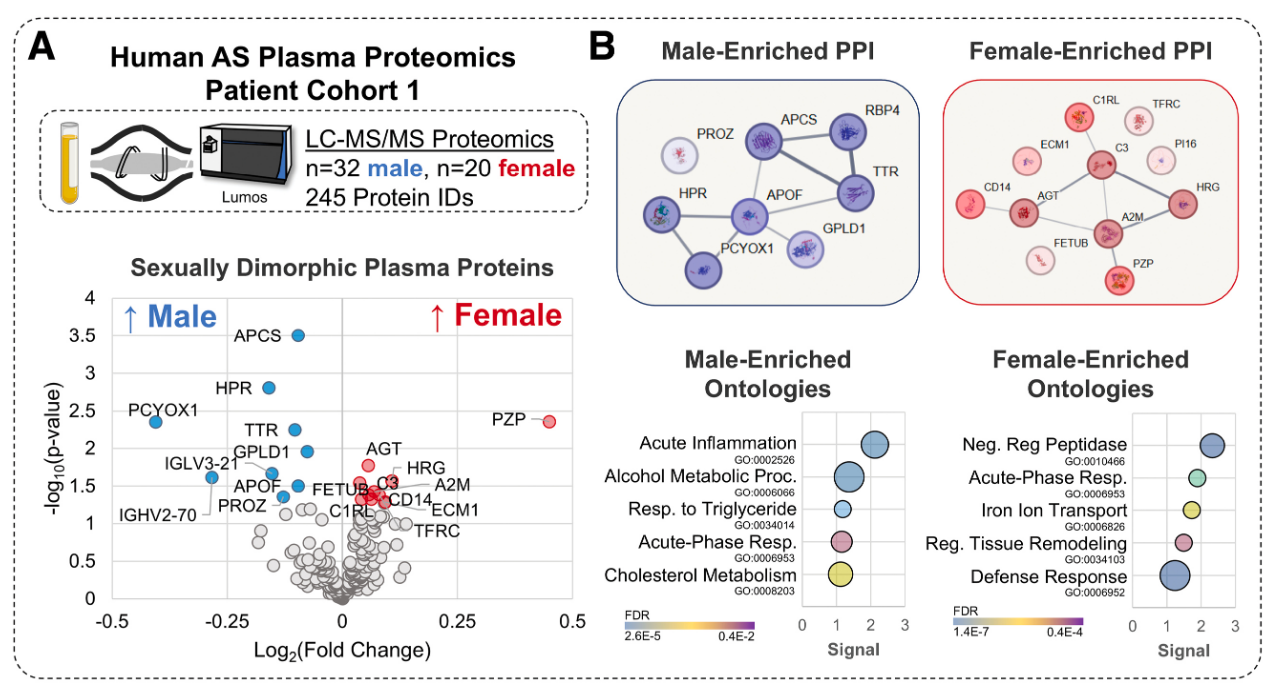
- 鉴定的循环蛋白: 本研究鉴定了20种在两性之间存在差异的循环蛋白。其中,妊娠区蛋白是唯一一种通过质谱法在基线健康人血浆队列中也被发现具有性别二态性的两种蛋白之一。
- 男性富集的AS血浆蛋白主要与急性炎症(如APCS、SAA2-4、APO A2、HPR)和胆固醇代谢(如APO L1/A4/A2/F)相关。
- 女性富集的AS血浆蛋白则与金属内肽酶活性(如HRG、C3、妊娠区蛋白、FETUB、A2M、血管紧张素原AGT、ECM1、PI16)和组织重塑(如HRG、AGT、TFRC、TF)相关。值得注意的是,女性AS血浆中血管紧张素原(AGT)的增加引人关注,因为血管紧张素受体阻滞剂仅在女性AS中与瓣膜纤维化呈负相关。
组织病理学与组织蛋白质组的性别差异(原文使用的是统计学名词 二态性:dimorphic)
- 样本和方法: 对年龄匹配的人AS组织样本(14名男性和4名女性)进行了分析。每个组织样本被分割为非疾病区、纤维化区和钙化区三个疾病阶段。组织病理学评估通过苏木精-伊红染色和von Kossa染色进行,并由病理学家进行半定量盲审评分,以评估炎症、纤维化和钙化程度。组织样本同样通过LC-MS/ms蛋白质组学进行分析。
- 临床特征差异: 在组织蛋白质组学队列中,**高血压的发生率(男性100% vs 女性25%, P=0.0004)和β受体阻滞剂的使用率(男性64% vs 女性0%, P=0.0233)在两性之间存在显著差异**。

- 组织病理学结果显示,多重逻辑回归分析发现男性与高钙化/高纤维化评分显著相关(n=14;P=0.0214),而女性则与低钙化/高纤维化评分显著相关(n=6;P=0.042)。

- 组织分段和蛋白质组聚类: 图1D 展示了瓣膜组织的疾病阶段分段策略。图1E 的主成分分析揭示了性别和疾病阶段特异性的蛋白质组聚类,表明疾病阶段是组织蛋白质组样本变异的主要驱动因素。
- 差异富集蛋白数量: AS发病机制驱动了瓣膜蛋白质组中的性别特异性差异。在所有疾病阶段中,总共有338/1503个蛋白表现出性别差异富集。图1F 显示,纤维化区域包含了最多的性别二态性蛋白(180/399个差异蛋白)。
- 疾病进展的独特性: 图1G 的维恩图表明,不同疾病阶段的性别二态性蛋白大部分是独特的,提示疾病进展在不同性别之间是独特的。
疾病阶段特异性组织蛋白质组分析

- 性内差异蛋白数量: 对每个性别内部的蛋白质组进行比较,发现女性在纤维化阶段的二态性蛋白数量是男性的2.75倍,而男性在钙化阶段的二态性蛋白数量是女性的2.47倍。
- 图2A 显示了非疾病阶段与纤维化阶段的差异蛋白数量。图2B 显示了非疾病阶段与钙化阶段的差异蛋白数量。

- 功能富集分析(图2C-D) 所示的功能富集分析 (FEA) 揭示了脂蛋白失调在两性AS发病机制中均存在。
- 性别特异性通路: 在纤维化阶段,男性特异性显著富集于核苷三磷酸途径,提示ATP分解代谢在男性AS中可能具有性别特异性作用。相比之下,女性AS中独特的显著富集是血小板-胶原粘附和胶原链三聚化,揭示了狭窄女性主动脉瓣高度纤维化的特定基础。
-
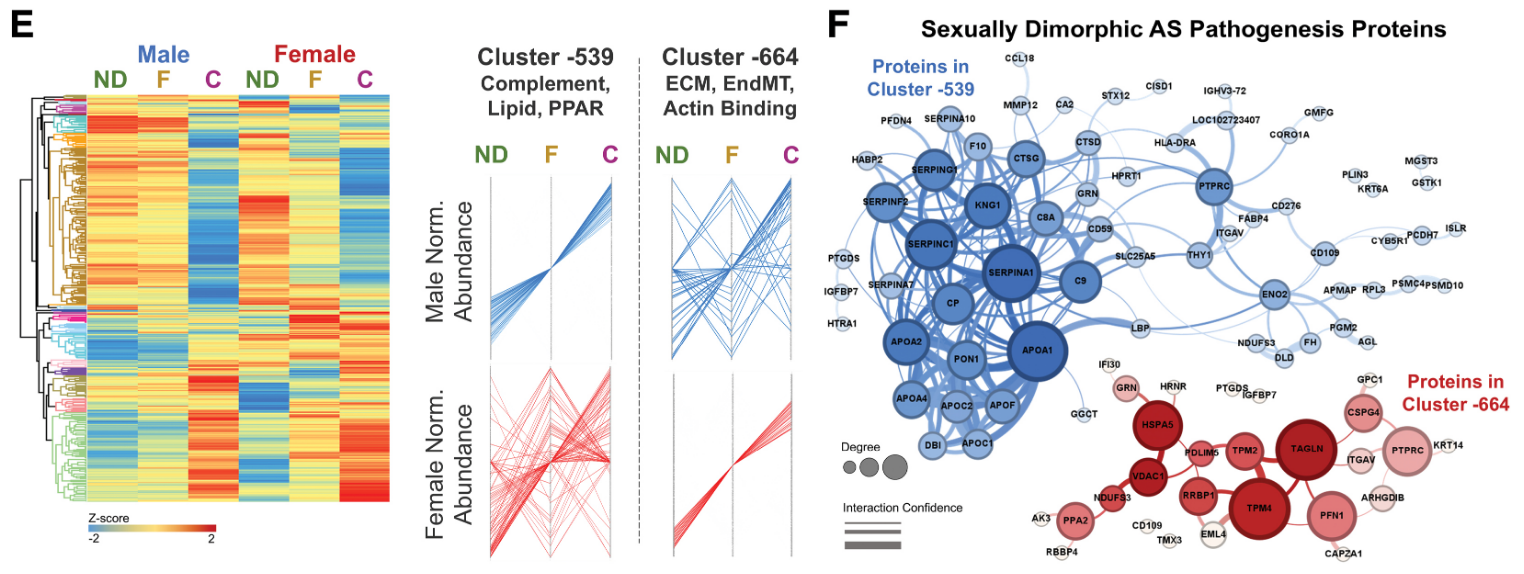
致病蛋白积累模式: 图2E 展示了仅在男性中积累(cluster-539)或仅在女性中积累(cluster-664)的致病蛋白及其蛋白质-蛋白质相互作用。
- 男性AS的疾病进展特征是补体激活、脂质积累和PPAR信号传导(如SERPINA1/C1/F2/A7/G1, APO A1/A2/A4/C2/C1/F)。
- 女性AS发病机制的特点是细胞外基质信号、内皮-间充质转化和肌动蛋白结合(如ITGAV, IGFBP7, ECM2, SPARCL1)。
验证结果
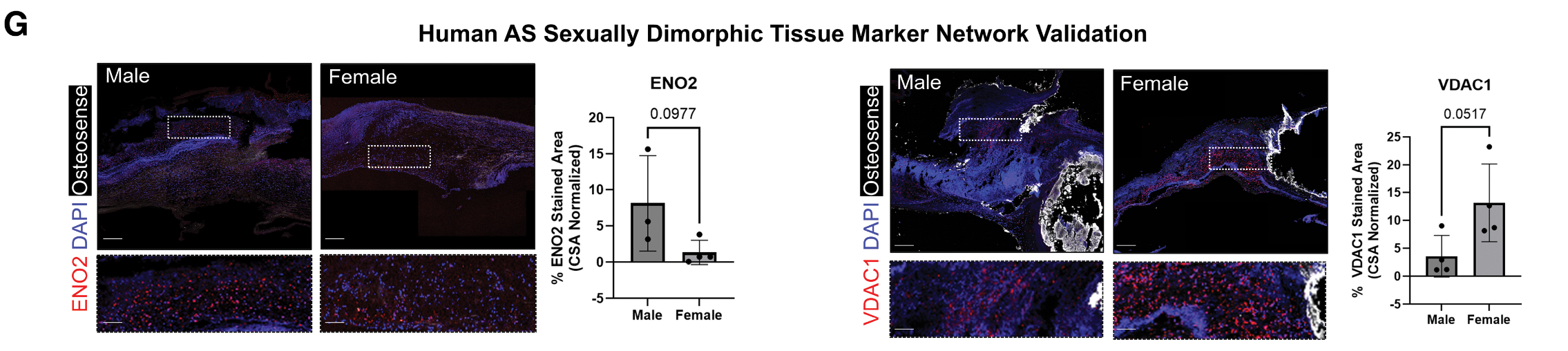
- 方法: 在一个独立的验证队列中(4名男性和4名女性),使用免疫组化染色法验证了潜在的性别特异性靶点,检测了VDAC1和ENO2。
-
验证发现: 图2G 显示:
- VDAC1(电压依赖性阴离子通道1)在女性AS组织中显著增加,VDAC1是心脏成纤维细胞活化的调节因子。
- ENO2(烯醇化酶2)在男性AS组织中呈现增加趋势,ENO2已被证明在TAVR术后会增加。
讨论
三个队列梳理
- 队列1: 年龄、种族和AS严重程度匹配的临床队列(32名男性和20名女性)的血浆样本
- 队列2: 年龄匹配的人AS组织样本(14名男性和4名女性)(高血压和β受体阻滞剂有性别差异)
- 队列3: 组织学验证队列(4名男性和4名女性)
创新性
-
本研究是首次对人AS组织中的性别二态性进行全面蛋白质组学研究,并首次报道了基于质谱的人AS血浆蛋白质组学。相较于以往依赖组织病理学(无法精确识别分子水平疾病指纹)或转录组学(与基质密集且细胞稀疏的主动脉瓣中的蛋白质特征相关性不佳)的研究,蛋白质组学能够更精确地揭示疾病的分子图谱。
-
本研究的发现揭示了AS发病机制中显著的性别特异性差异:
- 女性AS组织中富含胶原,并显示出特定的血小板和凝血酶激活信号升高。一些仅在女性AS纤维化中发现的胶原亚型富集于von Willebrand因子结合域,这表明血小板聚集和血栓形成可能在女性AS中发挥性别特异性作用。
- 男性AS的中间阶段富集于嘌呤能系统通路(三磷酸核苷相关) 。ATP水解外酶可能作为无机(焦)磷酸盐的来源,从而导致性别依赖性的羟基磷灰石结晶和钙化结节优先在男性中形成。
局限性
- 本研究成功鉴定了248种血浆蛋白,其中几种是AS中的性别特异性蛋白。然而,这些具有性别二态性的血浆蛋白与在AS组织中鉴定的性别特异性致病蛋白并不完全一致,血浆和组织之间仅有9.4%的总蛋白质组是共享的。
- 那么血浆蛋白质组的意义没有被明确阐释。
- 这些具有性别二态性的血浆蛋白可能有助于发现与晚期AS全身效应相关的生物标志物,例如射血分数降低(男性多见)或射血分数保留(女性多见)的心力衰竭。
总结
这项概念验证分析成功地识别了AS病理生物学中潜在的性别特异性蛋白质药物靶点。本研究的结果为未来的前瞻性假设驱动研究提供了启示和指导,旨在识别和开发针对男性和女性患者的性别特异性治疗策略,以应对这种迄今难以治愈的疾病。
数据公开
蛋白质组学原始数据可以用于二次分析:
血浆蛋白质组:PRIDE数据库 编号PXD064030 (https://doi.org/10.6019/PXD064030),当前处于未公开状态,网站通知可能会晚点公开。
组织蛋白质组:PRIDE数据库 编号PXD035538(https://doi.org/10.6019/PXD035538),目前已公开可获取。
主动脉瓣膜蛋白质组学的其他论文
- Schlotter F, 2018, Circulation——基于25枚人类狭窄主动脉瓣的“时空多组学”图谱,揭示瓣叶三层在疾病进展中的特异蛋白网络,并提出GFAP等层特异标志物。 (PMC)
- Bouchareb R, 2021, JACC: Basic to Translational Science——系统描绘人主动脉瓣及瓣间质细胞在钙化过程中细胞外基质(ECM)蛋白的丰度与通路变化,突出胶原与蛋白聚糖重塑。 (PMC)
- Martín-Rojas T, 2015, Scientific Reports(iTRAQ)——以iTRAQ定量比较狭窄/对照主动脉瓣ECM蛋白组,提示先天免疫与炎症相关ECM分子(如BGN)上调并参与退行性过程。 (Nature)
- Martín-Rojas T, 2012, Journal of Proteome Research——20例手术瓣与20例对照瓣的比较蛋白质组学揭示退行性主动脉瓣狭窄的差异ECM模式和相关通路。 (PubMed)
- Angel PM, 2011, Journal of Proteome Research——首次绘制健康成人肺动脉瓣与主动脉瓣的基础蛋白图谱(含>2700种蛋白),为后续病变比较提供参照。 (PubMed)
- Angel PM, 2021, Journal of Molecular Biology——“空间N-糖组学”显示人主动脉瓣结构受N-糖信号精细分区调控,提示糖基化在瓣膜重构/狭窄中的潜在作用。 (科学直通车)
- Blaser MC, 2023, Circulation——比较人颈动脉斑块与钙化主动脉瓣组织内“滞留的组织外泌体(EV)”蛋白/转录组货物,指出EV是推动瓣膜钙化的关键因子与通路节点。 (AHAA Journals)
- Clift CL, 2024, Science Advances——体外2D/3D力学微环境模型结合细胞内蛋白组与“外泌体学”表明,机械僵硬度通过VIC/内皮细胞跨向分泌与蛋白质重编程驱动纤维化-钙化耦联。 (科学组织)
- Decano JL, 2022, iScience——单细胞+蛋白组联合鉴定出钙化人瓣膜中一类“疾病驱动型”瓣间质细胞亚群,并解析其成骨/炎症表型的蛋白学基础。 (科学直通车)
- Fu B, 2022, Frontiers in Cardiovascular Medicine——患者队列的蛋白组-代谢组一体化分析揭示CAVD相关代谢-炎症-ECM重塑的协同改变,为标志物与通路干预提供候选。 (PMC)
- Shelbaya K, 2024, JACC——在ARIC队列中用大规模血浆蛋白组(SomaScan)发现MMP12与AS风险相关,并提出C1QTNF1为潜在阻断进展的新靶点。 (科学直通车)
- Tan ESJ, 2024, JAHA——血浆蛋白谱提示炎症/免疫调控相关蛋白与主动脉瓣狭窄患者的左室应激与不良结局相关,具有分层评估潜力。 (AHAA Journals)
- Bortnick AE, 2025, JAHA——老年人群血浆蛋白质组学验证并复制了3种与CAVD显著相关的循环蛋白,强化其作为易感/筛查标志物的证据。 (AHAA Journals)
- Ma W, 2021, Frontiers in Cardiovascular Medicine——BAV患者的血浆蛋白组学发现可预测升主动脉扩张进展的候选标志物,强调BAV特异的系统性分子指征。 (PMC)
- Gil-Dones F, 2012, Journal of Proteomics(血浆)——比较AS患者与对照的血浆蛋白谱,提出分级/随访的生物标志物线索与样本前处理策略。 (PubMed)
- Perez KA, 2024, American Journal of Cardiology(综述专题)——总结组织/血浆/尿液蛋白组在CAVD机制与生物标志物探索中的优势与新方法学进展。 (科学直通车)
本文研究了钙化性主动脉瓣狭窄(AS)中血浆和组织蛋白质组的性别差异。通过LC-MS/ms技术,分析了32名男性和20名女性的血浆样本,发现20种循环蛋白在两性之间存在显著差异。男性的富集蛋白与急性炎症和胆固醇代谢相关,而女性则与金属内肽酶活性和组织重塑相关。此外,组织样本分析显示:在14名男性和4名女性的组织样本中,高血压发生率和β受体阻滞剂的使用在两性间差异明显。男性更多表现出高钙化/高纤维化特征,而女性则相反。进一步分析表明,在不同疾病阶段,各性别的二态性蛋白数量和功能富集存在显著差异。女性在纤维化阶段的二态性蛋白数量是男性的2.75倍,而男性在钙化阶段的数量是女性的2.47倍。这些结果提示AS的性别差异不仅影响临床特征,还反映出潜在的分子机制,为未来的性别特异性治疗提供了依据。













暂无评论内容