EHJ:活化的血小板促进成骨并推动钙化性主动脉瓣狭窄的进展
Activated platelets promote an osteogenic programme and the progression of calcific aortic valve stenosis
Article type: Original Article
Files: ehy696.pdf
Institute: Laboratory of Cardiovascular Pathobiology, Department of Surgery, Quebec Heart and Lung Institute/Research Center, Laval University, 2725 chemin Ste-Foy, Quebec, G1V-4G5, Canada;
Publication Year: 2019
Rating: ⭐⭐⭐⭐⭐
Status: Finished
Tags: Animal Model, Platelets
要点
科学问题
活化的血小板是否可以促进瓣膜钙化?如果可以,则是通过何种机制产生效应?
整体思路及结论
活化的血小板可以促进VICs的钙化进展(体外及体内实验验证)
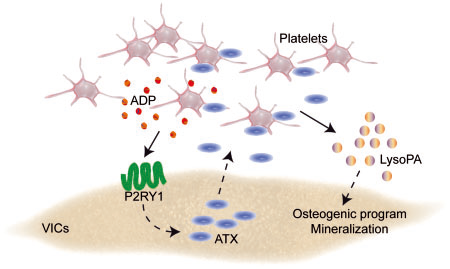
- 活化的血小板分泌
ADP,其促进VICs生成ATX。 ATX可以促进血小板在瓣膜表面聚集,并且将血小板的代谢产物溶血磷脂进一步降解为溶血磷脂酸(LysoPA)(血小板中富含磷脂酶A,故血小板代谢产物中含有大量的溶血磷脂。)LysoPA可以促进VICs的钙化进程。
细胞生物学技术整理
- 扫描电镜(SEM)
- 观察到在CAVS患者瓣膜表面的血小板聚集现象
- 胶体金颗粒特异性标记
GPⅡb-Ⅲa(免疫胶体金技术) IGFII小鼠(LDLR-/-/ApoB100/100/IGFII (on C57Bl/6J background))模型中观察到相同现象- 实验处理后各组小鼠瓣膜表面比较以验证细胞实验结论
- 细胞免疫荧光
- 在分子和组织水平验证实验处理后小鼠VICs成骨活动的差异。
- Transwell 共培养
- 活化的血小板是通过分泌某些信号分子来促进VICs的钙化,而不是通过细胞连接。
- RNAi
- 瞬转siRNA敲低靶基因表达
研究背景
凝血异常与CAVS的相关性
- 主动脉瓣狭窄引起的局部高剪应力(high shear stress)可以导致vWF多聚体的降解,导致2A型获得性血管性血友病 von Willebrand syndrome。这些患者的凝血酶和血小板的活化都增加。
- CAVS患者血液中血小板来源的微粒增加。
- 手术切除的钙化瓣膜中存在组织因子。
- 瓣膜所受的高剪应力和局部的湍流容易活化内皮细胞,增加血小板的黏附,血小板释放的一些物质具有促成骨活性(如溶血磷脂 lysophosphatidic acid)。
主要数据及结论
扫描电镜(SEM)下观察到CAVS患者瓣膜表面存在血小板聚集
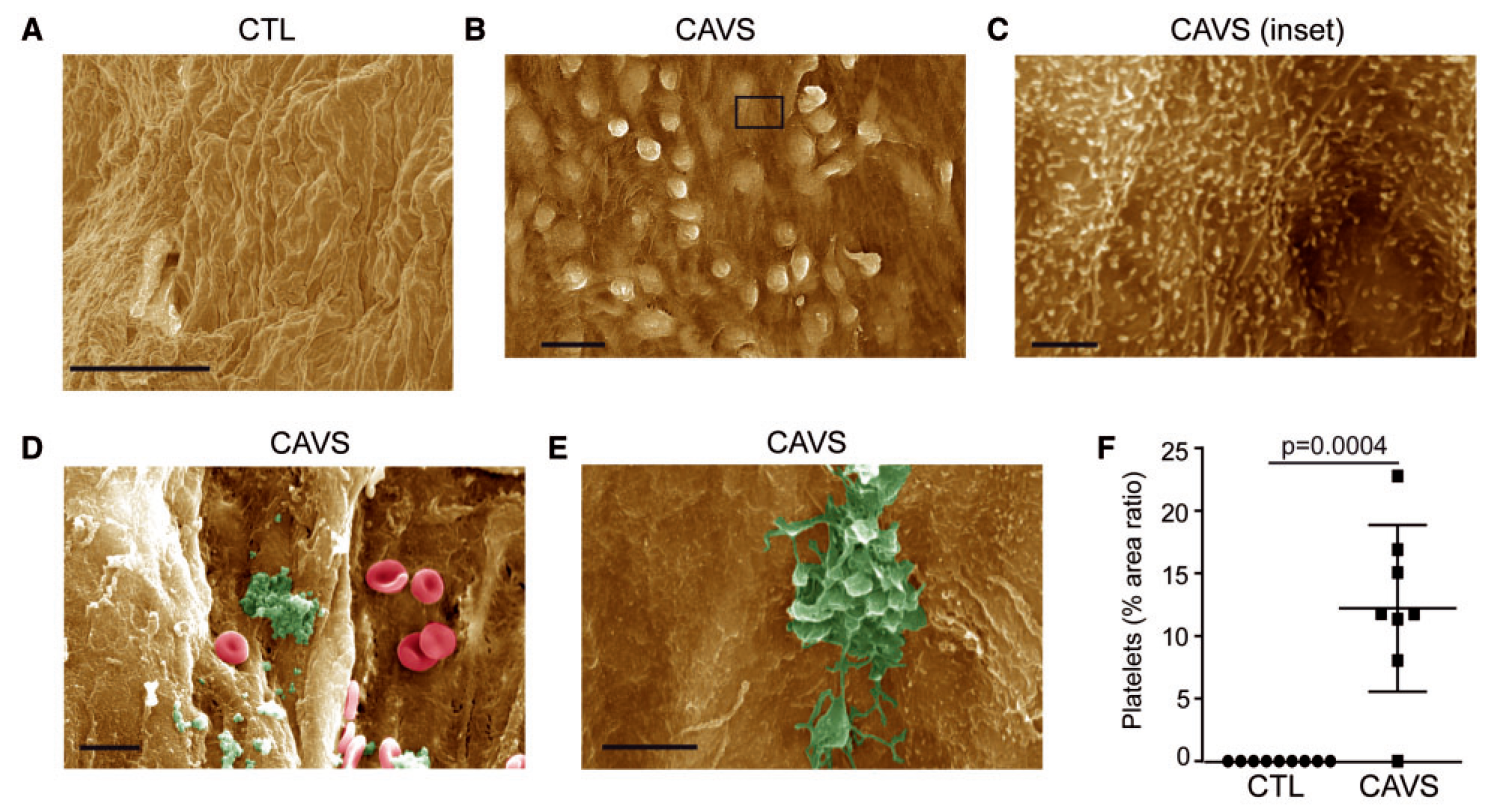
A是对照组,无钙化的瓣膜朝向主动脉的一面。B~E均为钙化性主动脉瓣狭窄(CAVS)病人瓣膜朝向主动脉的一面。
B可见CAVS瓣膜表面内皮细胞排列不规则,并形成突起,放大看到表面有微绒毛形成皱襞,这是内皮细胞被激活的表现。

VCAM1作为内皮细胞活化的标志物,通过WB检测发现,对照组未检测到VCAM1表达,而钙化组表达。
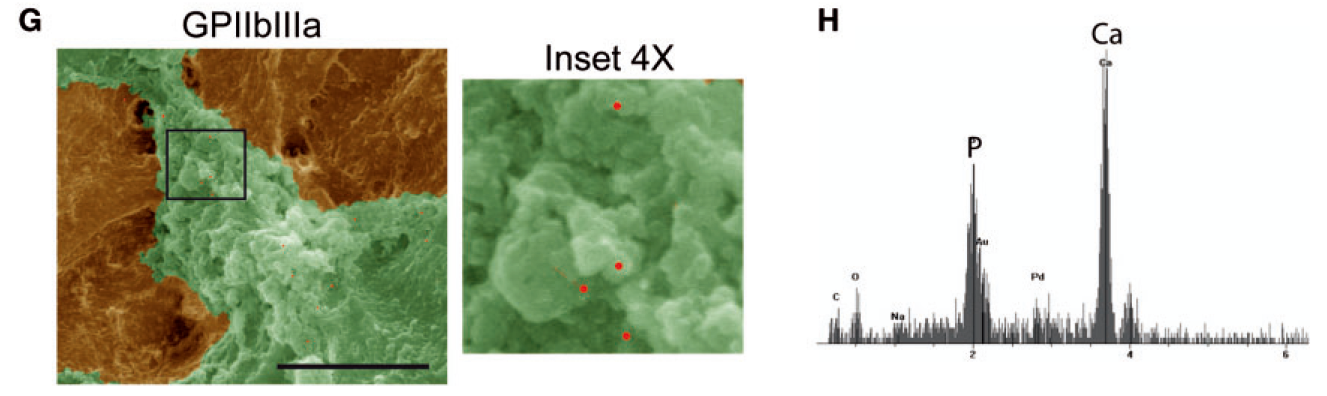
血小板膜糖蛋白 Ⅱb-Ⅲa 作为血小板的标记物,用胶体金颗粒标记,在扫描电镜下观察,G图中红点表示的是糖蛋白 Ⅱb-Ⅲa 的位置。
H图为EDX能量色散检测元素含量,可见Ca和P含量较高,表明钙化确实存在。

活化的血小板在可以促进体外培养的VIC发生钙化
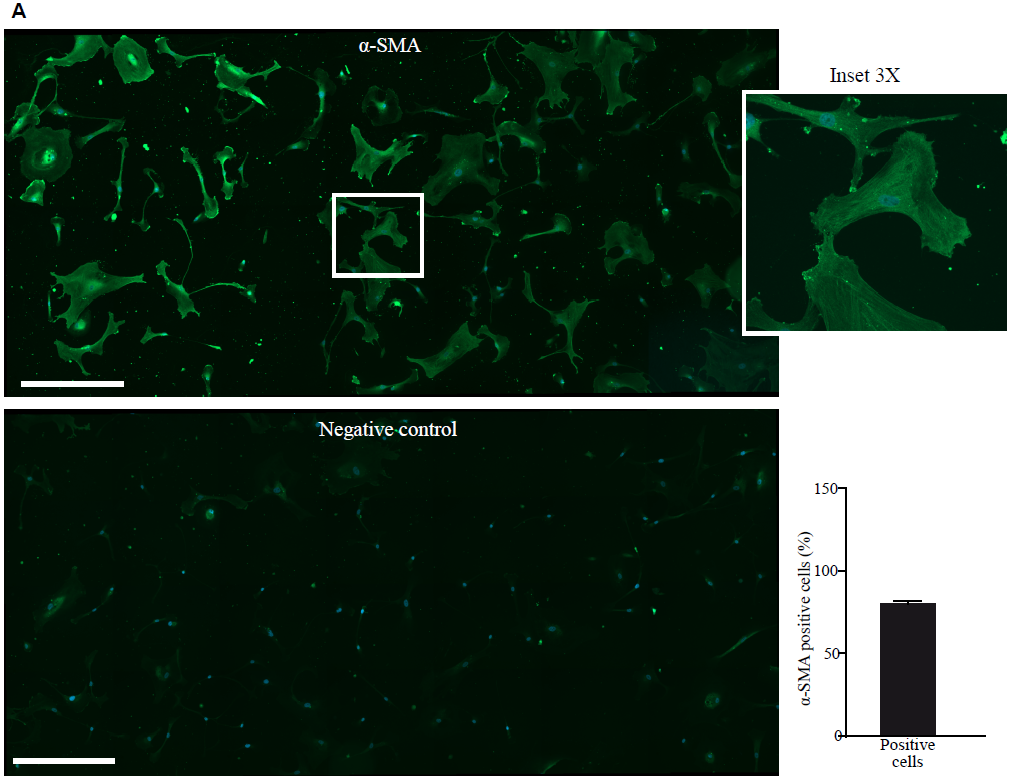
免疫荧光检测 α-SMA 作为成纤维细胞活化的标志,检测到81%的α-SMA阳性细胞
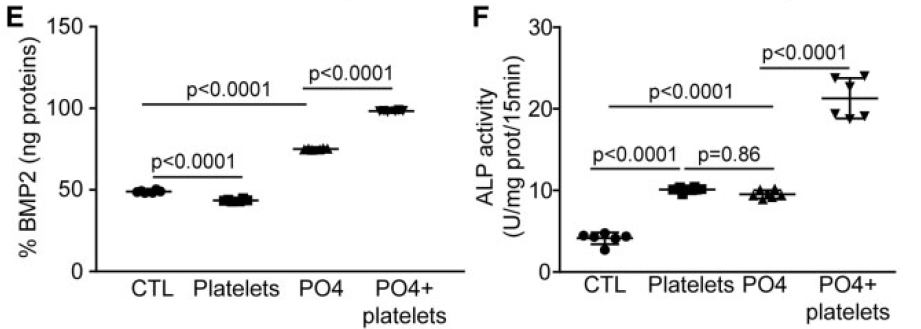
VIC培养分四组,CTL是VIC在普通培养基中培养,Platelets是普通培养+活化的血小板,PO4是一种钙化培养基,PO4+Platelets是钙化培养基中+活化的血小板。检测的效应指标是细胞外基质中钙的量作为钙化提示,用蛋白含量修正。
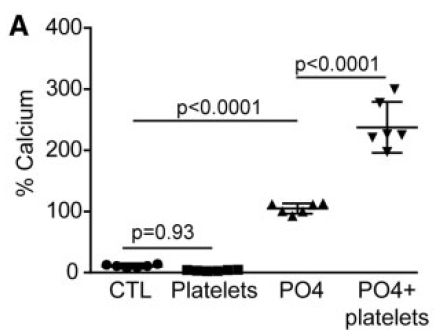
可见在钙化培养条件下,加入活化的血小板,钙化含量提高了130%
上面证明了活化的血小板可以促进VIC的钙化,那么这种促进作用是通过什么实现的呢?是细胞接触后的信号还是血小板分泌的一些可溶性物质?作者使用了transwell的方法来共培养,证明了是可溶性物质促进VIC的钙化。
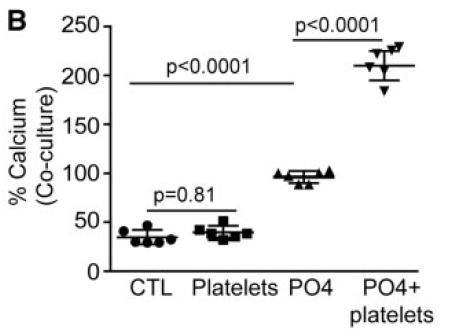
将VIC铺到底板里,transwell小孔里加入活化的血小板。
结果表明活化的血小板与VIC共培养可以显著促进VIC钙化。
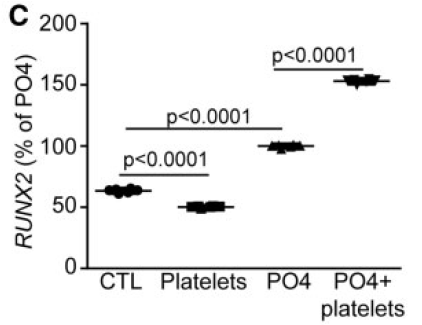
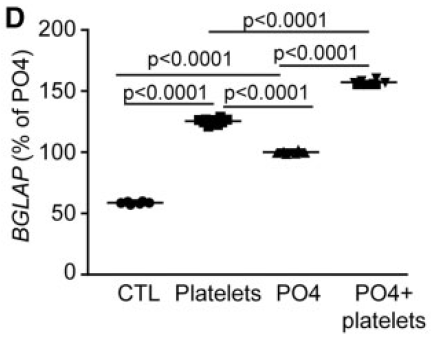
血小板诱导的钙化依赖于VIC产生的autotaxin及其下游产物溶血磷脂酸
VIC中高表达autotaxin(ATX),是一种溶血磷脂酶,由于血小板表达磷脂酶A1,可以产生溶血磷脂,溶血磷脂在ATX作用下降解为溶血磷脂酸(LysoPA)。
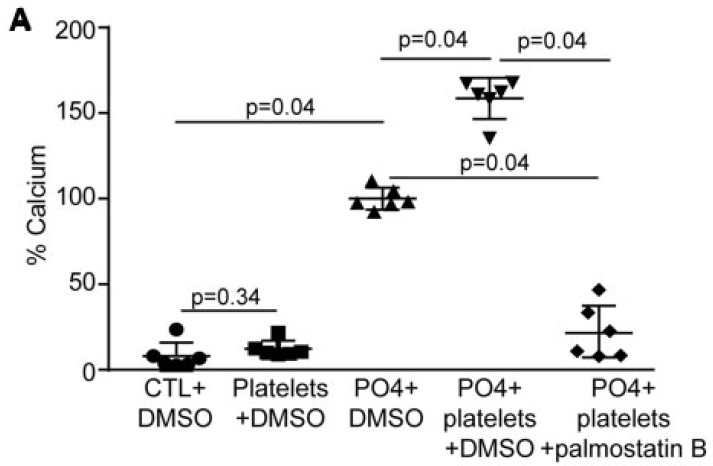
palmosatin B是磷脂酶A1、A2的抑制剂,加入之后血小板无法产生溶血磷脂,加入palmosatin B后钙化水平降低。
结果表明ATX或LysoPA可能可以促进钙化。
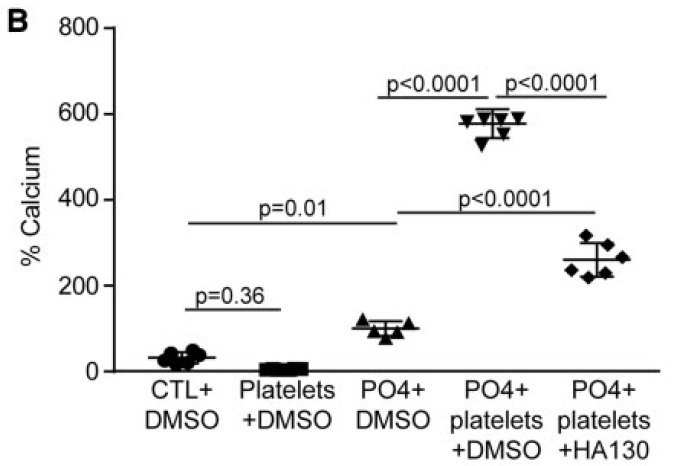
随后加入HA130,是ATX抑制剂。结果表明抑制ATX以后,血小板促进的钙化效果明显降低。
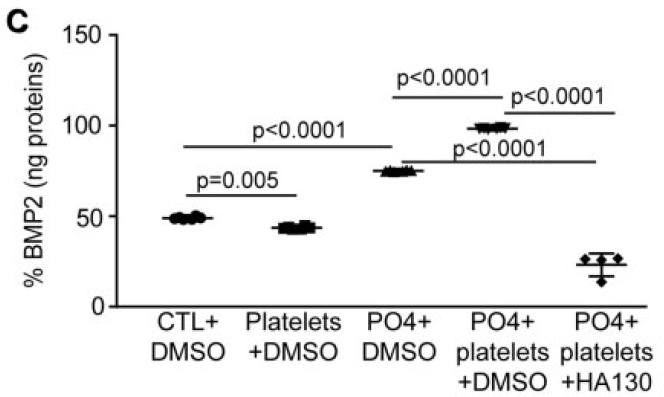
加入HA130以后,由血小板诱导的BMP2表达量也显著降低。
并且,在这个实验中发现,加入HA130以后VIC的BMP2表达量甚至低于普通培养条件的本底水平。
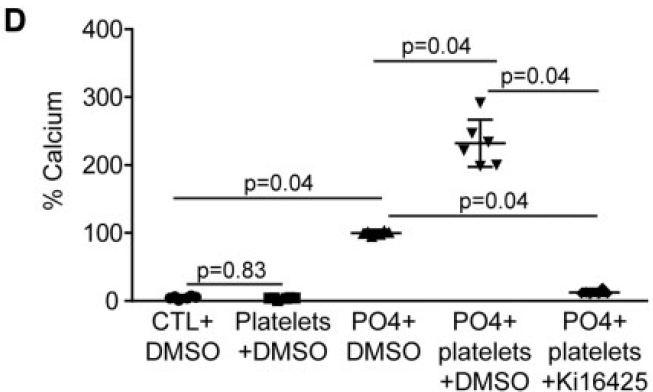
加入Ki16425(LysoPA受体1~3 抑制剂)后,血小板活化引起VIC钙化的效果消失了。
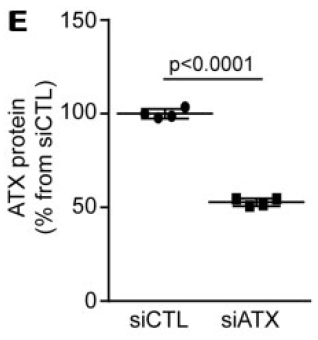
靶向ATX的siRNA干扰后用ELISA方法检测ATX的表达量降低
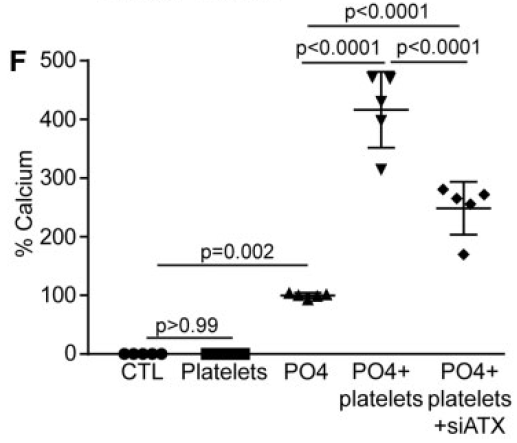
加入siATX后钙化水平降低

使用ELISA方法检测相应培养条件下LysoPA的含量,发现血小板与VIC共培养时,LysoPA含量升高了4.1倍,而加入HA130后则没有这个效果。
血小板源性ADP通过P2Y1受体促进VICs表达ATX
活化的血小板诱导活性ATX的释放
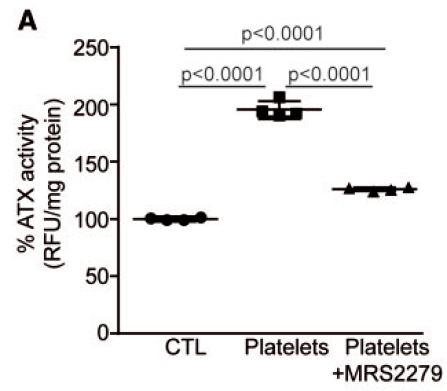
加入 MRS2279(P2RY1抑制剂)后,降低了ATX的活性水平
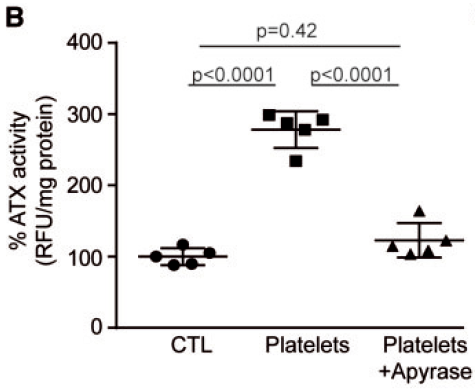
加入apyrase(可降解ADP)后,ATX水平降低
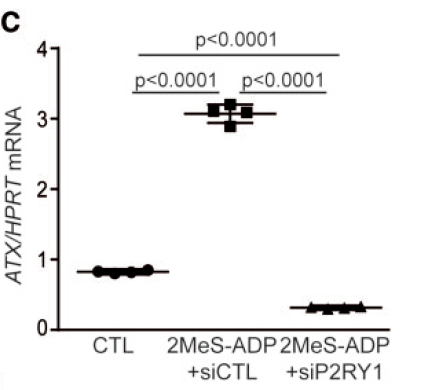
2MeS-ADP 是P2RY1受体激动剂,加入后显著提高了ATX活性;而同时加入siRNA敲除P2RY1后,ATX活性显著不增高。
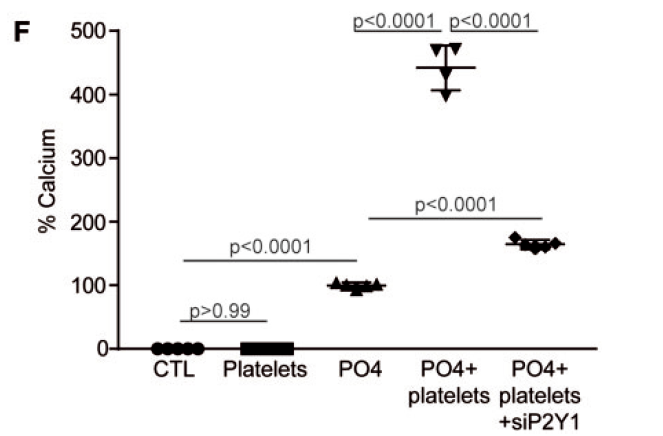
敲除P2RY1显著降低了血小板诱导的VIC钙化水平
ATX通过与 GPⅡb-Ⅲa 的相互作用促进VICs的钙化

RGDS是一个肽段(Arg-Gly-Asp-Ser),可以与整合素β1、β3相互作用,结果表明其可以减少ATX与血小板的结合,效果呈剂量依赖性。

GR144053 是GPⅡb-Ⅲa 抑制剂,加入之后消除了ATX与血小板的结合效果
以上数据表明,血小板通过其表面的整合素GPⅡb-Ⅲa捕获ATX,并最终促进VICs的钙化。
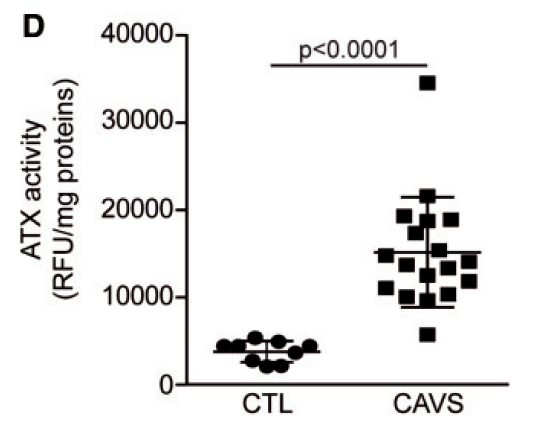
临床样本进行分析,结果表明CAVS患者血小板源性的ATX活性也是增高的(取的血小板样本)
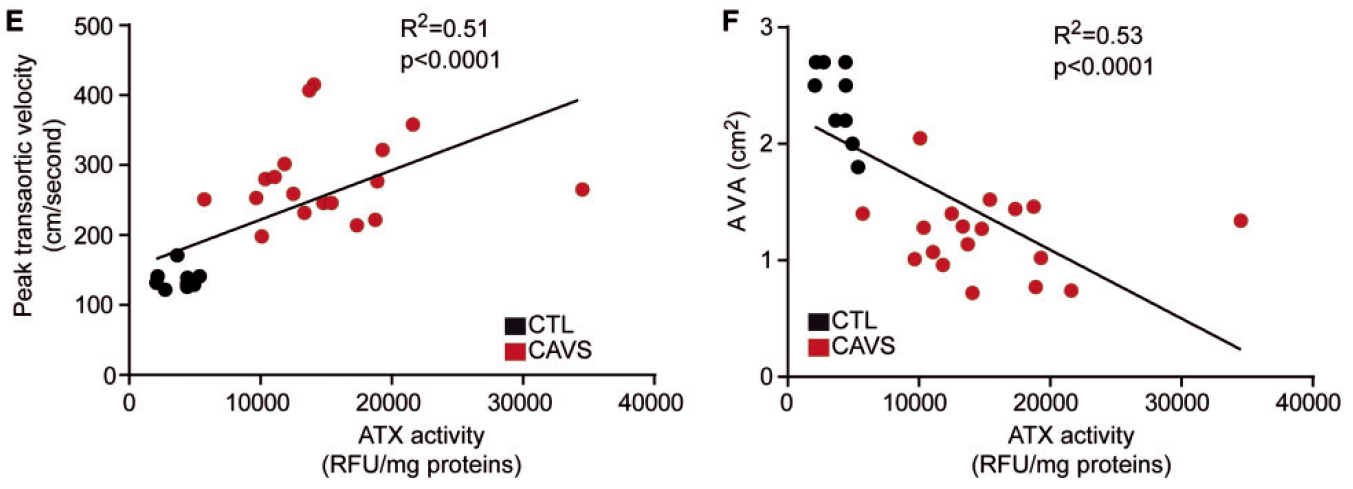
对患者检测发现,ATX活性与跨主动脉峰流速呈正相关,与主动脉瓣面积呈负相关
活化的血小板会促进小鼠主动脉瓣狭窄
使用的CAVS小鼠模型为LDLR-/- apoB100/100 IGFII 转基因小鼠(IGFII)+高脂高糖饮食(HFHS)
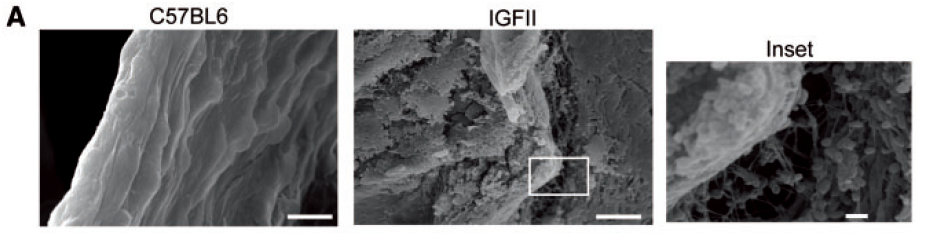
为了明确在动物模型中的表型,作者首先在SEM下观察发现 IGFII小鼠 HFHS 喂养6个月建立CAVS模型后,在其主动脉瓣膜面向主动脉一侧(即纤维层fibrosa)可见血小板聚集,而对照WT小鼠为阴性。(IGFII小鼠主动脉瓣被观察区域有血小板覆盖的平均面积比例为11%)
那么血液循环中被活化的血小板是否能够促进主动脉瓣的狭窄呢?作者从WT小鼠体内分离血小板后给IGFII小鼠静脉注射。
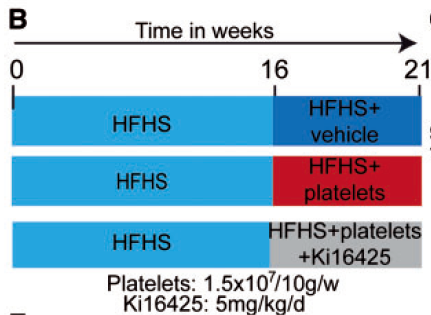
vehicle表示注射了药物溶剂的对照组,也称溶剂组
由于该动物模型HFHS喂养16周后开始出现早期的瓣膜病变,并伴有血流动力学改变,故从16周开始连续5周每周注射一次血小板。(对照组IGFII小鼠注射生理盐水)
为了明确lysoPA是否参与这个过程,增加一组小鼠,注射血小板的同时加入Ki16452(Lpar1~3抑制剂)

以跨主动脉瓣血流峰流速作为效应指标,观察CAVS的进展情况。(流速越高说明瓣膜狭窄越严重)实验处理前,经超声心动图检测,两组小鼠跨主动脉血流峰流速无统计学差异,注射血小板5周后即HFHS处理21周后发现,注射血小板促使小鼠CAVS的进展加快了2.1倍。
Ki16425的加入消除了血小板诱导的狭窄进展。
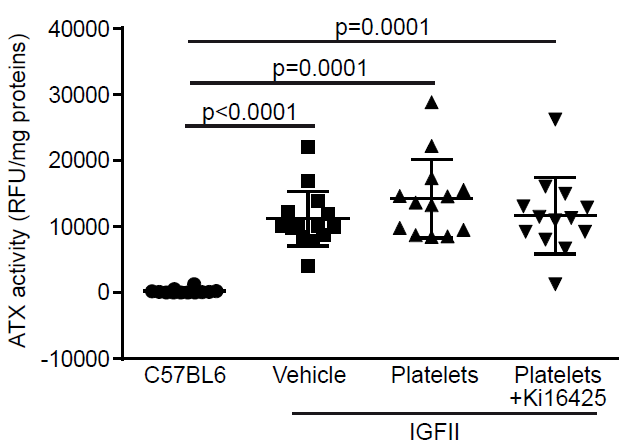
检测三组小鼠血小板内ATX活性水平发现,与WT小鼠相比,IGFII小鼠均增高,且不受活化的血小板或是Ki16425存在的影响
小鼠处死后,电镜下观察到注射了血小板的小鼠瓣膜表面发现大量血小板和纤维附着:

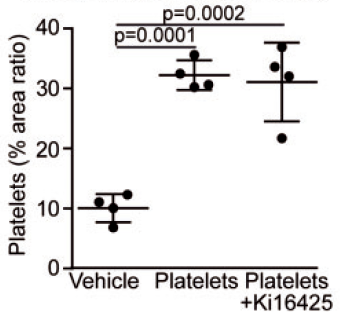
将三组小鼠瓣膜镜下观察到的血小板附着面积进行统计分析,结果表明注射活化的血小板可以明显导致血小板在瓣膜表面聚集,并且Ki16425没有消除该效果。
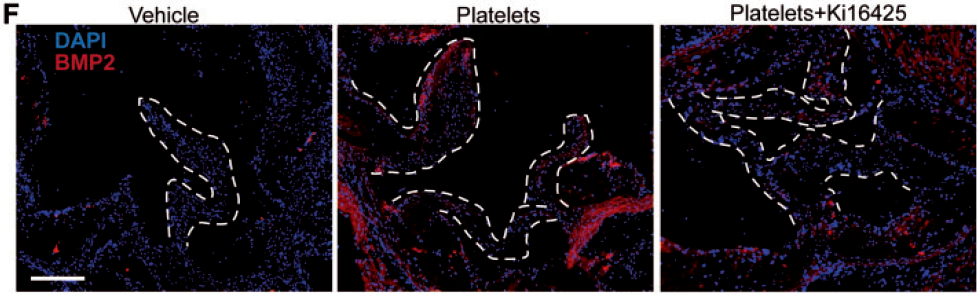
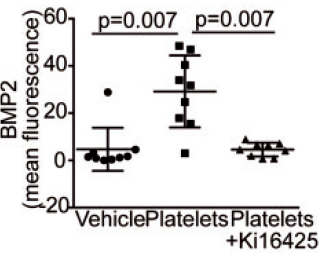
使用免疫荧光进一步检测成骨标志物BMP2的的表达差异发现:(分子水平)
注射了活化血小板的小鼠瓣膜BMP2表达显著增高,而同时加入Ki16425可以消除该效应!
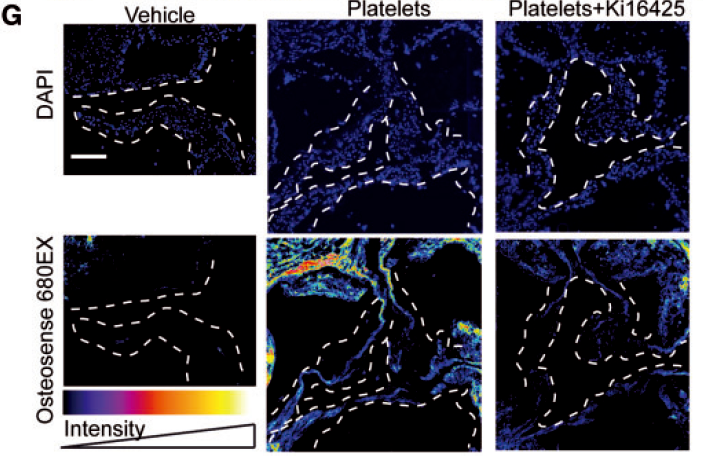
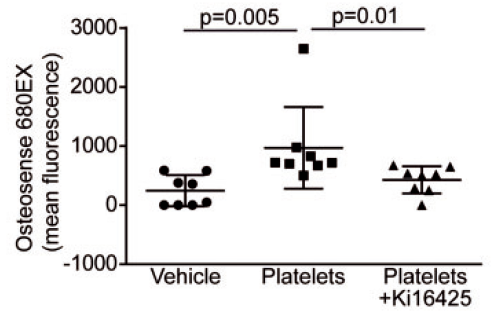
为了进一步在组织水平检测成骨活性,通过近红外荧光检测羟磷灰石钙(骨骼中的主要钙盐)的含量,发现活化的血小板显著促进成骨活性,而Ki16425消除了其促进作用。
本研究探讨了活化血小板对钙化性主动脉瓣狭窄(CAVS)进展的影响。结果显示,活化血小板通过分泌ADP促进心脏瓣膜间质细胞(VICs)的成骨程序,进一步导致钙化。研究利用多种技术(如SEM、免疫荧光等)验证了血小板在瓣膜表面的聚集及其促钙化作用,为理解CAVS的机制提供了新见解。













暂无评论内容