CVR:FOXS1介导胆固醇转运失调驱动主动脉瓣钙化研究
标题: Oxidized LDL-induced FOXS1 mediates cholesterol transport dysfunction and inflammasome activation to drive aortic valve calcification
期刊:Cardiovascular Research
Graphical Abstract
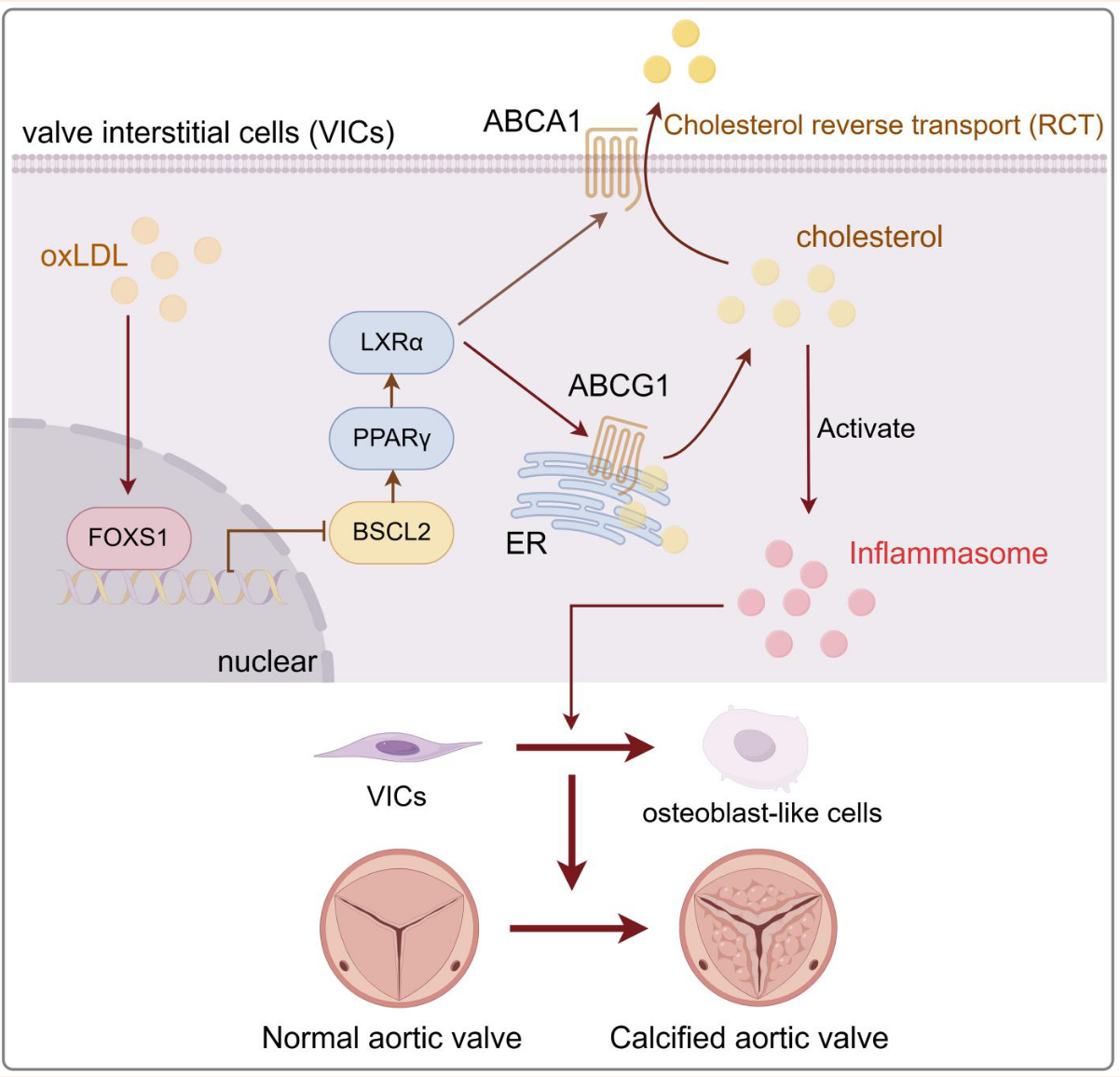
引言
CAVD的临床现状与挑战
钙化性主动脉瓣疾病(CAVD)是一种极其显著的心脏瓣膜疾病,且其发病率正随着全球人口老龄化的加剧而日益升高。尽管 CAVD 的临床负担沉重,但目前主要的治疗手段仍局限于手术置换主动脉瓣,而现有的人工瓣膜在耐用性等方面存在固有的局限性。更为严峻的是,目前临床上尚无任何有效的药物疗法能够阻止或延缓 CAVD 的进展。因此,深入探究 CAVD 的分子发病机制,并寻找新的治疗靶点以开发有效的药物,已成为心血管研究领域的当务之急。
瓣膜钙化的病理生理过程与脂质的作用
过去,CAVD 被认为是一种不可逆的退行性病变,但现代研究表明其病理过程高度复杂且受多因素调控,主要包括内皮损伤、脂质积累、慢性炎症反应以及细胞衰老。在这一过程中,瓣膜内部的关键病理演变是瓣膜间质细胞(VICs)向成骨样细胞表型的转化,最终导致钙盐沉积。
- 早期关键指标: 脂质沉积被认为是瓣膜钙化发生的起始指标。
- 脂质与炎症的关联: 积聚在瓣膜内的低密度脂蛋白(LDL)会介导慢性炎症,并进一步加速钙化的病理进程。
“他汀悖论”与氧化低密度脂蛋白(oxLDL)
长期以来,LDL 被视为心血管事件的核心驱动因素。临床研究证实,使用他汀类药物降低 LDL 水平能显著降低冠心病、心肌梗死及中风的风险。然而,尽管他汀类药物能大幅降低 LDL 水平,但其对 CAVD 的治疗获益却十分有限。 这一现象提示,LDL 与 CAVD 之间的关联可能具有独特的生物学机制。研究指出,天然状态的 LDL 致病能力并不强,其对瓣膜的损害主要源于其被修饰后的形式——氧化低密度脂蛋白(oxLDL) 。尽管已知 oxLDL 能促进 VICs 的成骨分化,但其背后的具体分子机制仍未完全明确。
转录因子与 FOXS1 的研究空白
转录因子(TFs)通过结合 DNA 序列来控制基因活性,是细胞响应外部信号(如脂质沉积)的关键蛋白。Forkhead box (FOX) 蛋白家族是一类重要的转录因子,在心脏发育及多种心血管疾病(如心肌病、动脉粥样硬化)中发挥关键作用。
- FOXS1 的已知功能: 作为 FOX 家族成员,FOXS1 此前主要被报道与多种癌症的细胞增殖、侵袭及上皮-间质转化(EMT)有关。
- 研究切入点: 在本研究之前,关于 FOXS1 与心血管疾病(尤其是 CAVD)之间的关系尚未有任何文献报道。
胆固醇转运障碍与研究假说
胞内胆固醇水平的失调是许多疾病(包括动脉粥样硬化)的共同特征。ABC 转运蛋白(如 ABCA1 和 ABCG1)负责介导胆固醇逆向转运(RCT),对维持细胞内胆固醇平衡至关重要。虽然在巨噬细胞中,ABC 转运蛋白缺失会导致 NLRP3 炎性小体激活并加速动脉粥样硬化,但这些转运蛋白在 CAVD 及 VICs 中的作用尚不清楚。
本研究的科学假设: 研究团队假设,早期的脂质沉积通过激活特定的转录因子(如 FOXS1),干扰了 VICs 的胆固醇转运功能,导致胞内胆固醇蓄积并触发炎症,从而驱动瓣膜钙化。这一机制的揭示可能为 CAVD 的早期预防和精准治疗提供全新的策略。
本文的主要研究结果
1. 鉴定 oxLDL 诱导的转录因子 FOXS1 在 CAVD 患者 VICs 中的表达(引出 生信)
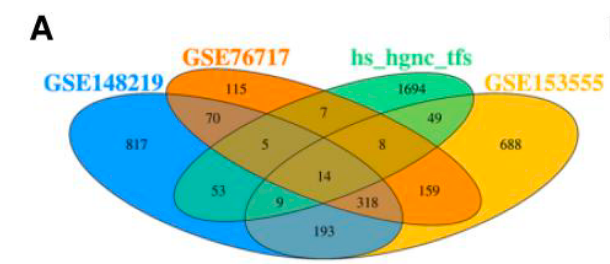
- 差异基因筛选: 对比三个 GEO 数据库(GSE148219、GSE76717、GSE153555)的上调基因与人类转录因子列表,鉴定出 14 个候选转录因子 (Figure 1A)。
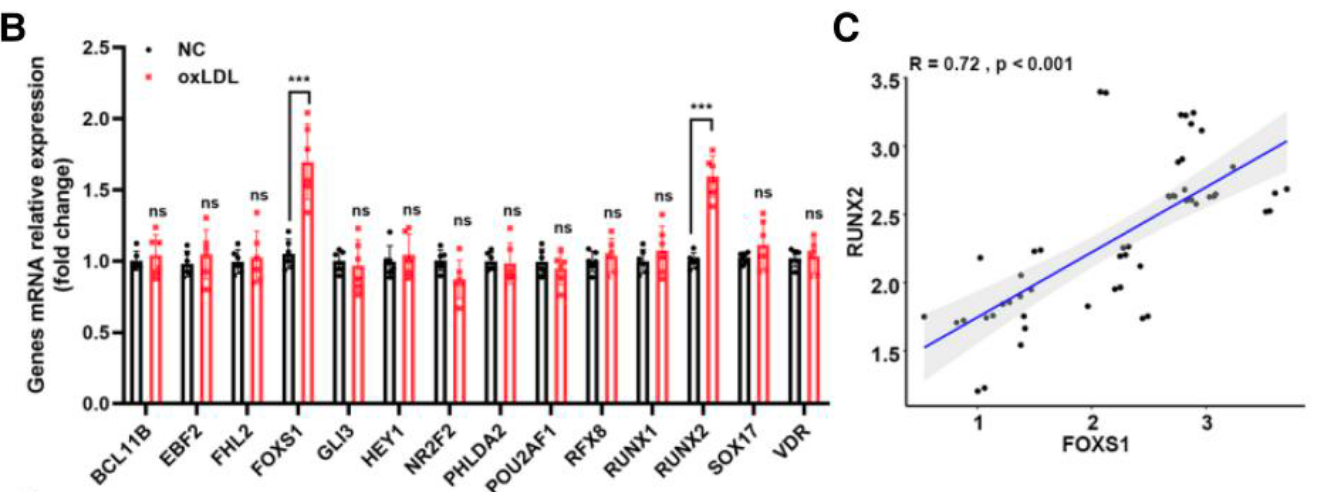
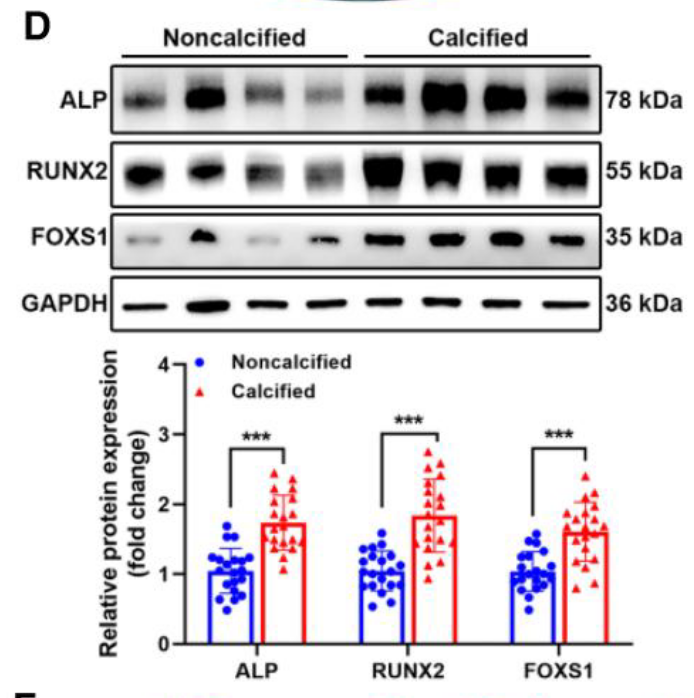
- 体外表达验证: 利用 qRT-PCR 检测 oxLDL 处理的人 VICs,发现 FOXS1 表现出最显著的激活反应 (Figure 1B)。临床样本分析显示,FOXS1 在钙化瓣膜中显著上调,且与成骨标记物 RUNX2 表达呈正相关 (Figure 1C, 1D)。
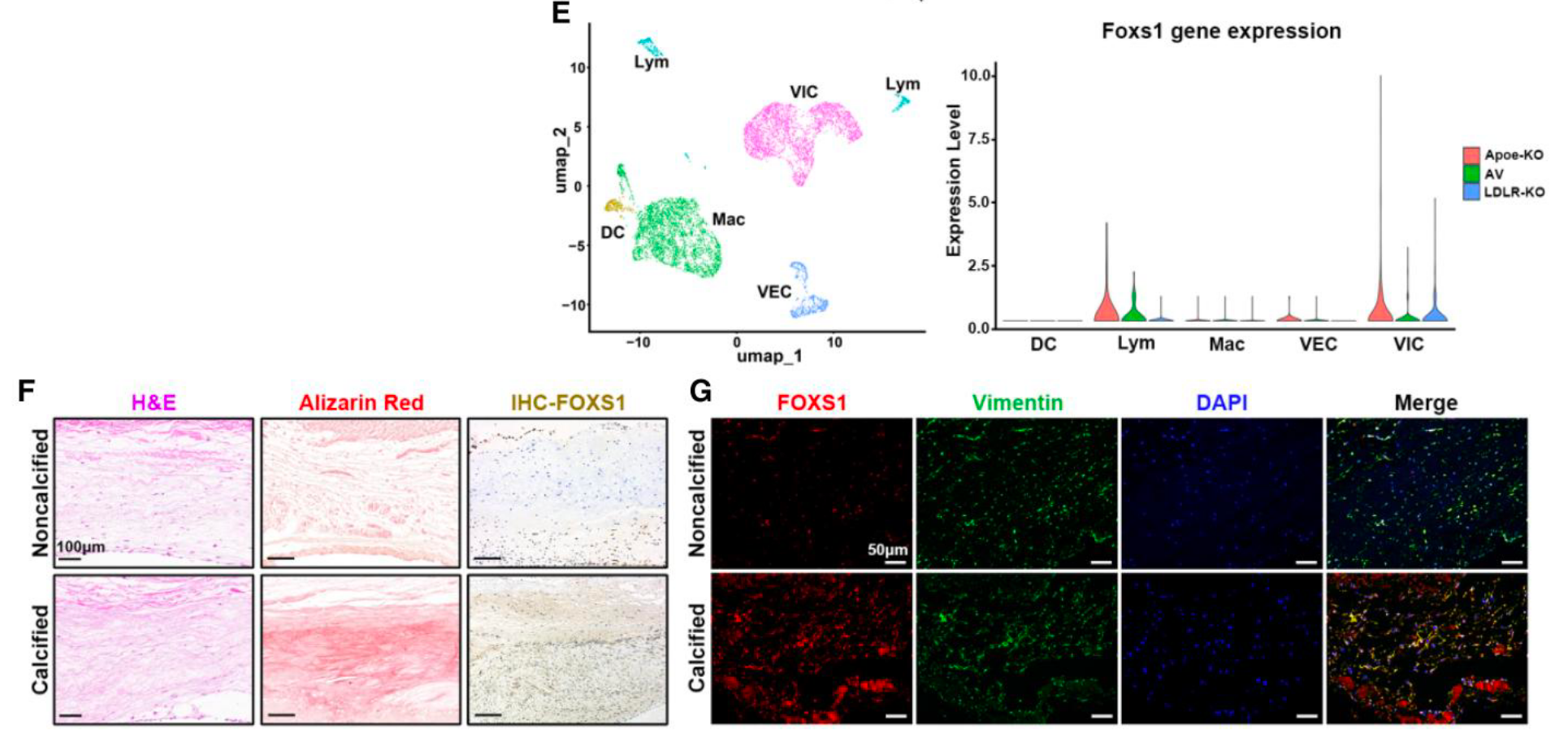
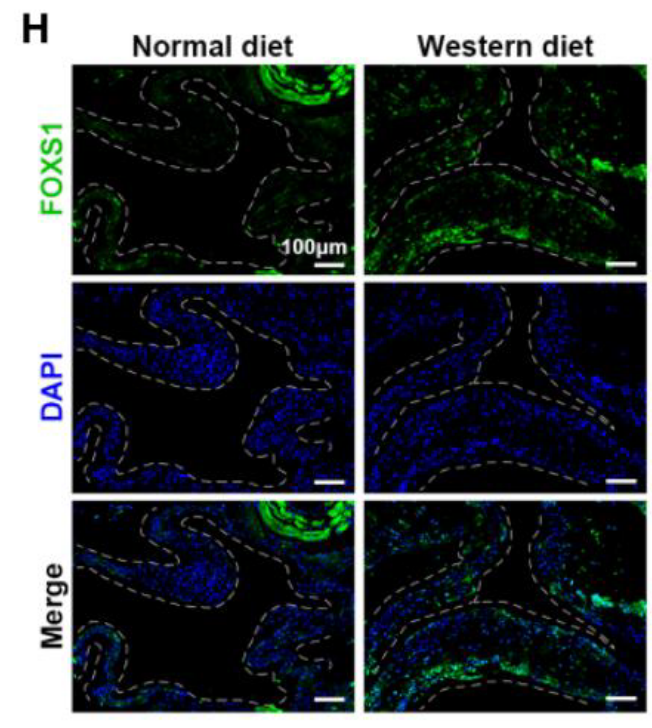
- 细胞与组织特异性: 单细胞测序(scRNA-seq) 表明 FOXS1 在高脂饮食小鼠瓣膜的 VICs 中特异性高表达 (Figure 1E)。组织学染色(Alizarin Red、IHC)与免疫荧光(IF) 证实,FOXS1 在钙化区域高表达并与 VIC 标记物 Vimentin 共定位 (Figure 1F, 1G)。
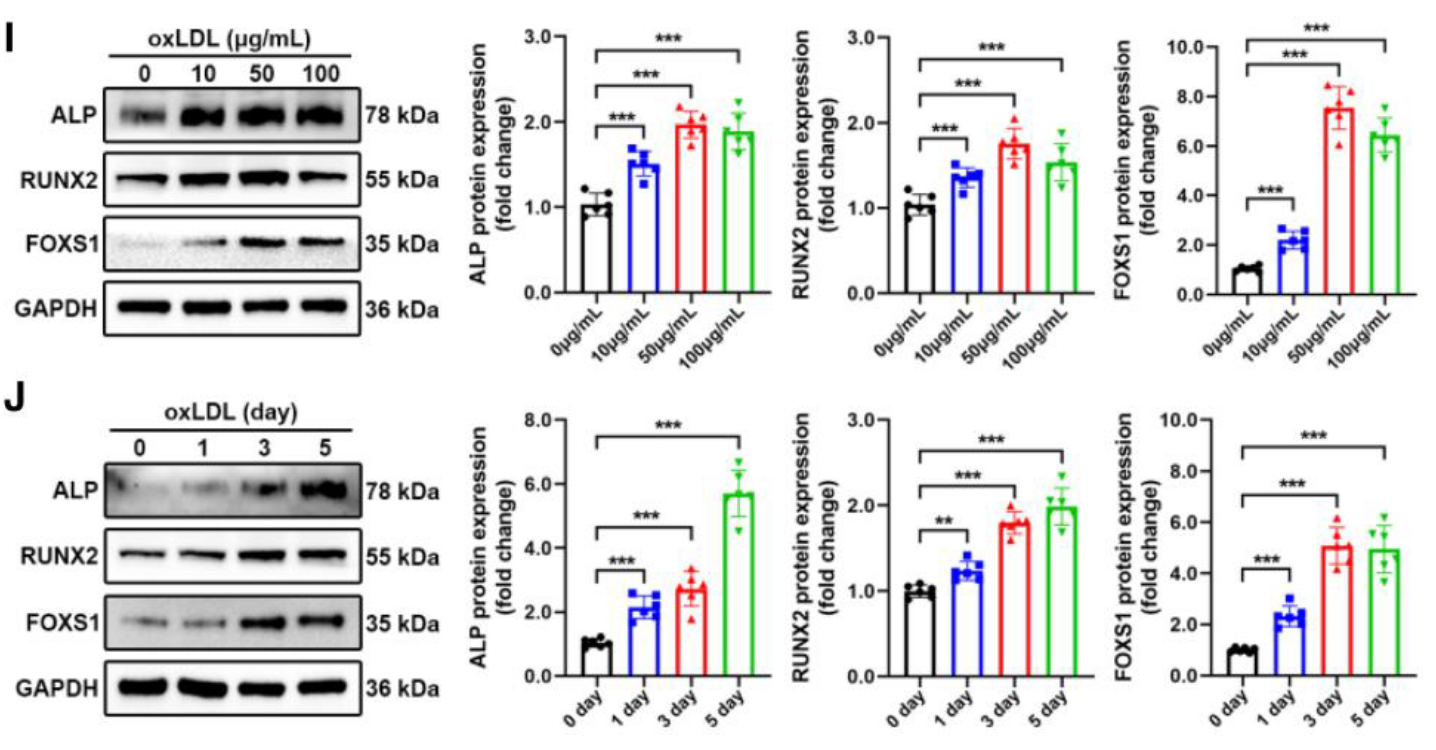
- 诱导条件探索: 通过 Western blot 发现,oxLDL 诱导 FOXS1 表达具有明显的浓度依赖性(50 μg/mL 达峰)和时间依赖性 (Figure 1I, 1J)。
2. FOXS1 促进 oxLDL 诱导的 VICs 成骨分化 (表型:In Vitro)
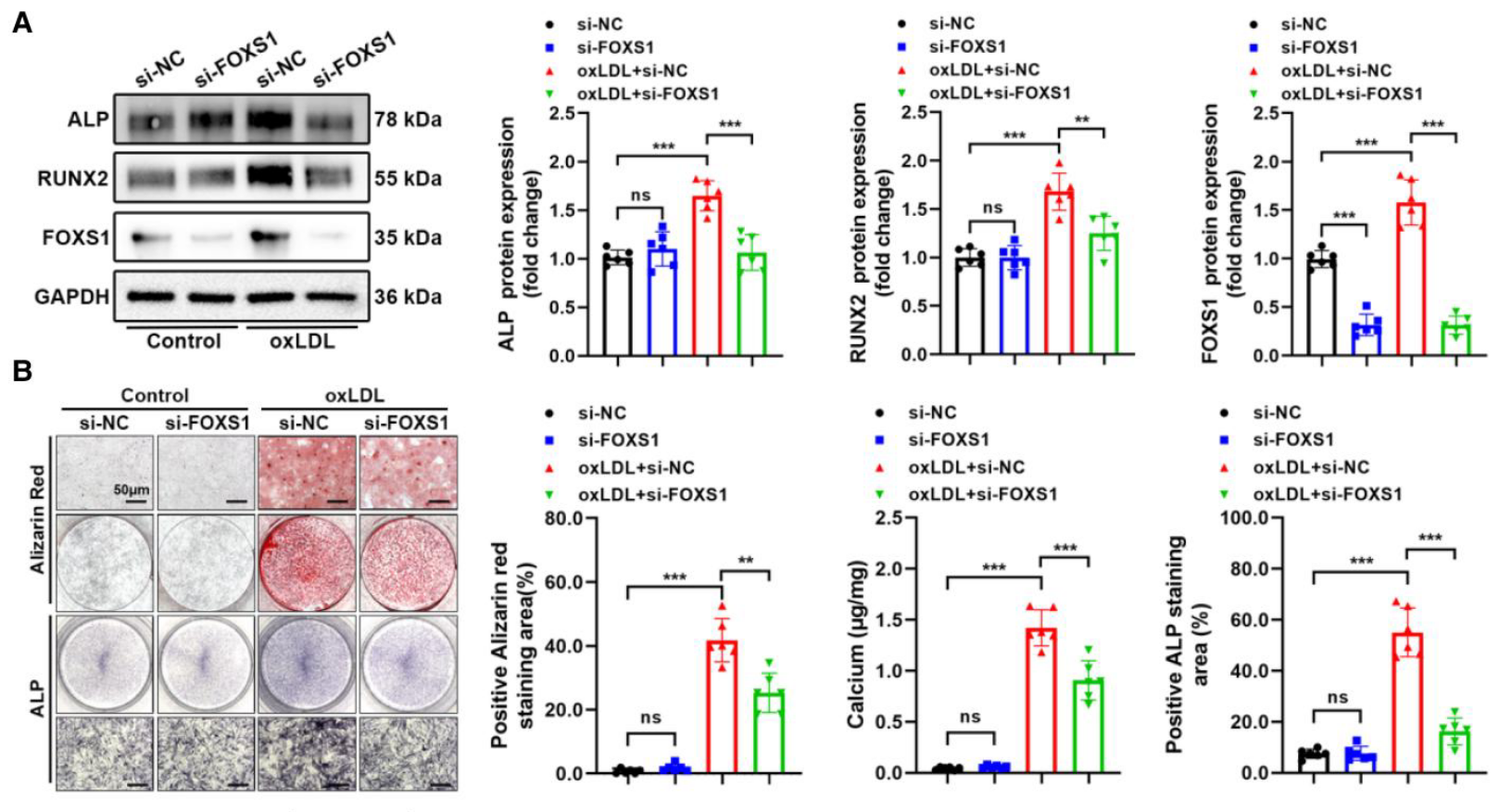
- 敲低实验: Western blot 显示敲低 FOXS1(si-FOXS1)可逆转 oxLDL 引起的 ALP 和 RUNX2 蛋白升高 (Figure 2A)。同时,茜素红染色、钙含量检测及 ALP 染色 证实 FOXS1 缺失显著减少了钙盐沉积 (Figure 2B)。
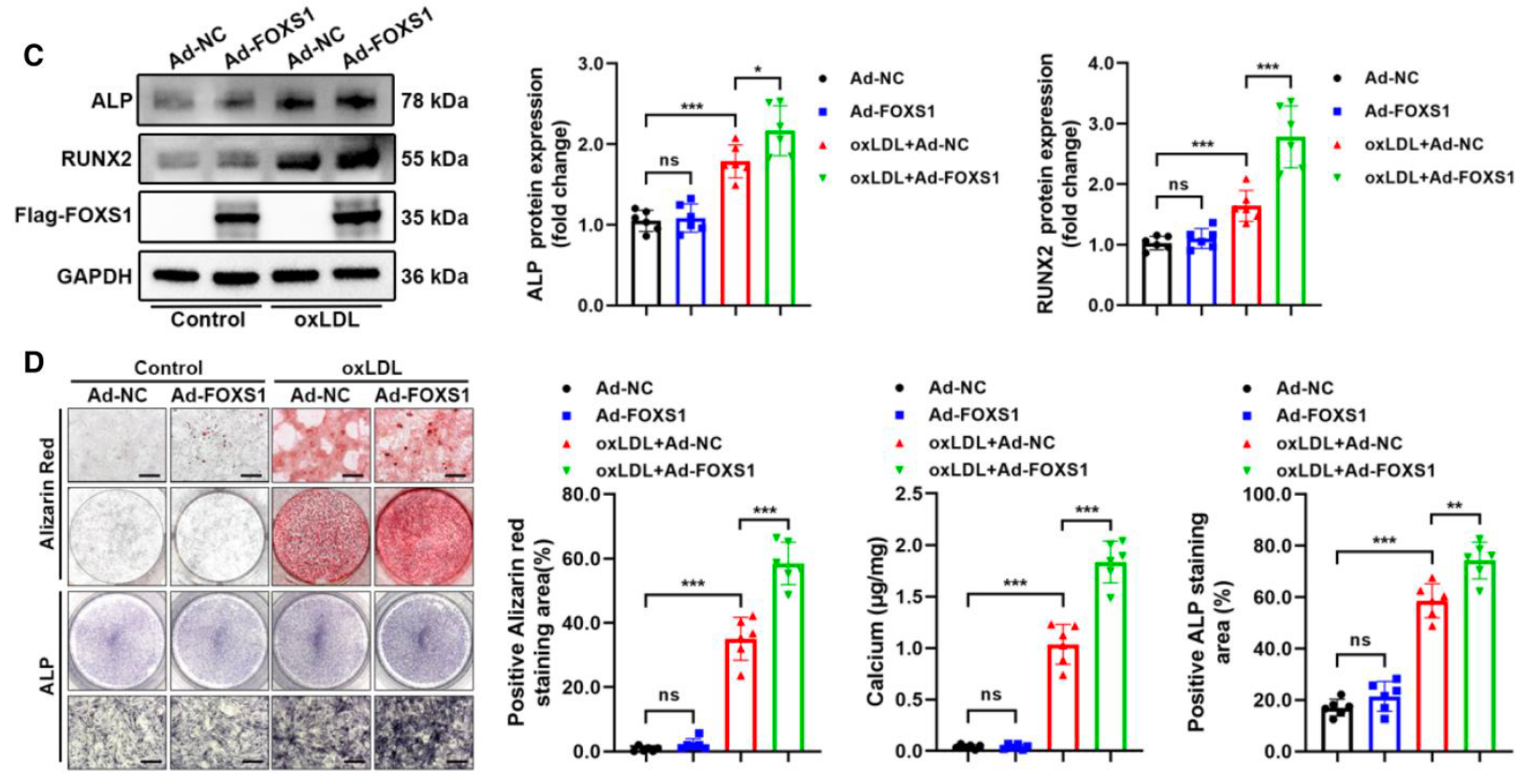
- 过表达实验: 利用腺病毒(Ad-FOXS1)提高 FOXS1 水平,结果显著增强了成骨蛋白表达并加剧了钙化程度 (Figure 2C, 2D)。
3. FOXS1 缺失在体内减轻主动脉瓣钙化 (表型:In Vivo)
研究者构建了 Apoe,Foxs1 双基因敲除小鼠模型 进行体内验证
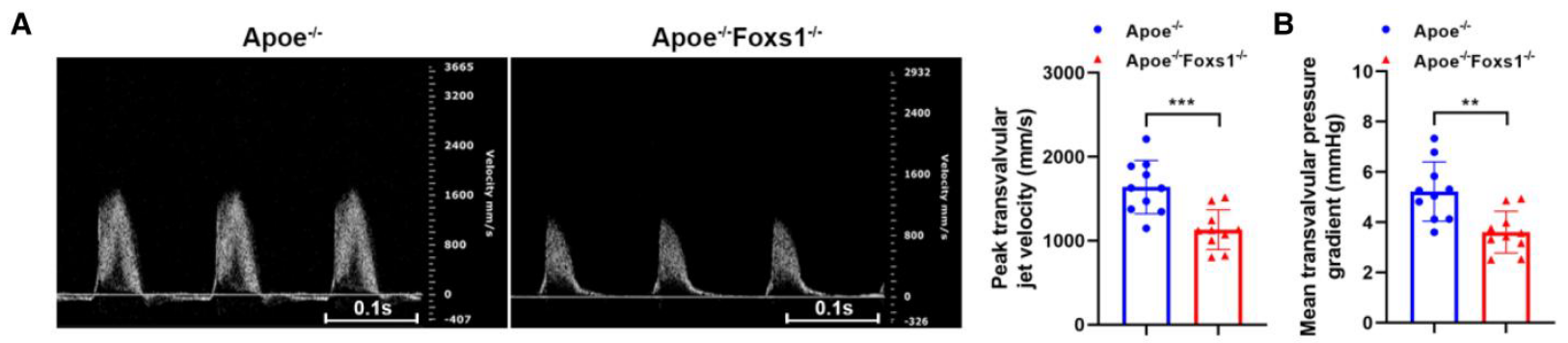
- AV狭窄评估: 经过 24 周高脂饮食(HFD)诱导后,超声心动图 检测显示,Foxs1缺失显著降低了主动脉瓣峰值流速 (Figure 3A) 和平均压力阶差 (Figure 3B)。
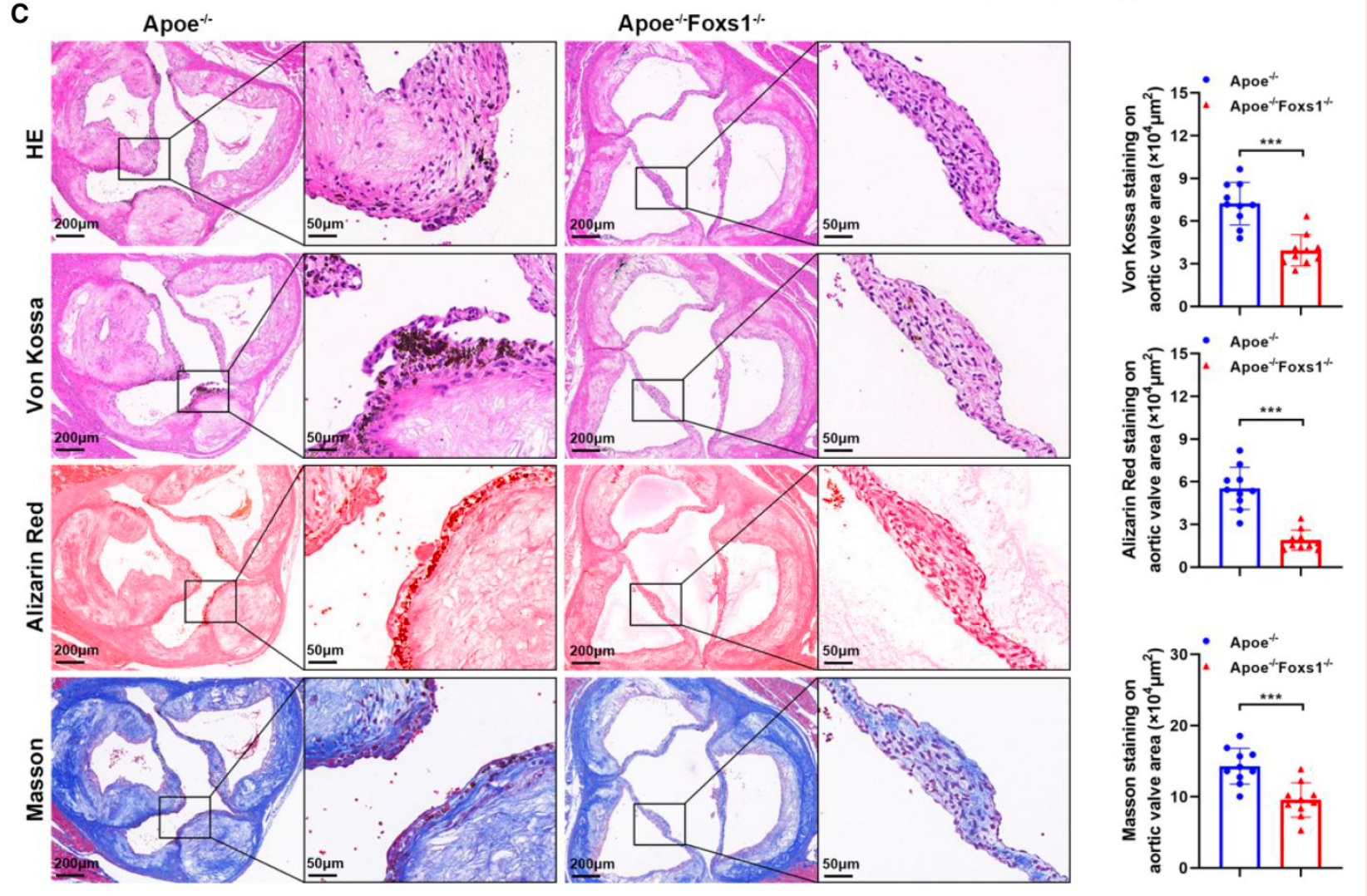
- 组织病理评估: 通过 HE、Von Kossa、茜素红及 Masson 染色 对瓣膜切片分析发现,FOXS1 缺失小鼠的瓣膜钙化面积和纤维化程度均显著减轻 (Figure 3C)。
4. FOXS1 通过抑制 ABCA1 和 ABCG1 介导成骨分化(机制)
通过 RNA-seq 探索 FOXS1 调节的分子机制:
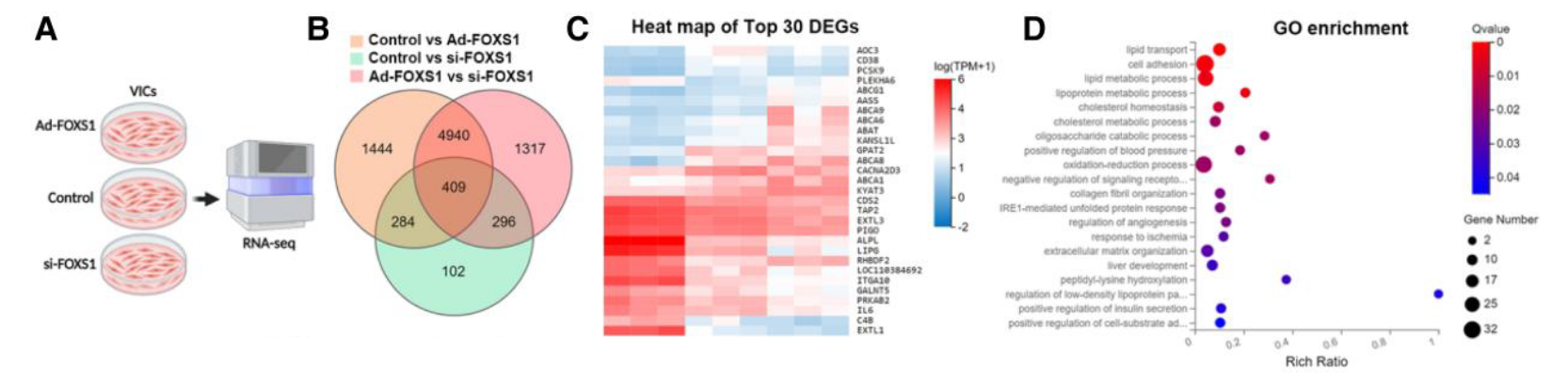
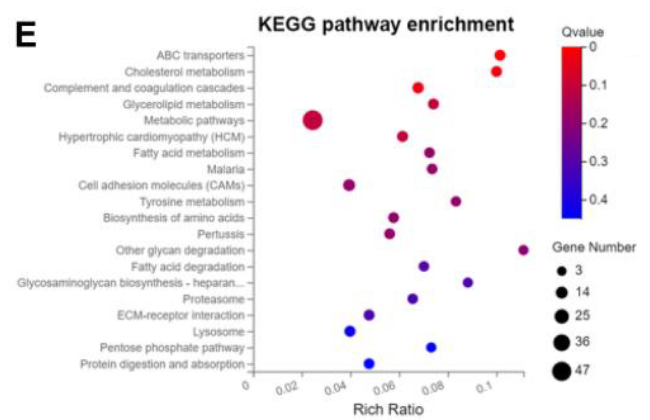
- 通路筛选: 对 Ad-FOXS1 和 si-FOXS1 组的差异基因进行 GO 和 KEGG 富集分析,发现其显著影响脂质转运和 ABC 转运蛋白通路 (Figure 4A-4E)。
- 可能的问题:没有区分上下调;差异分析的对照不标准
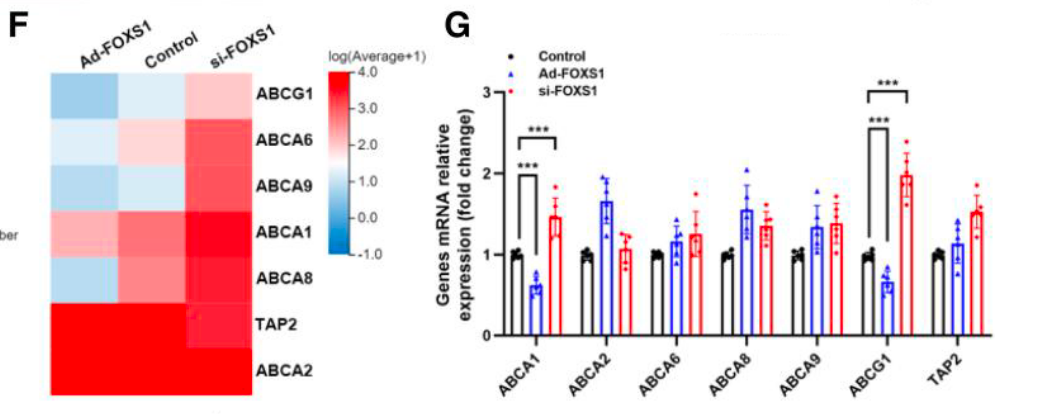
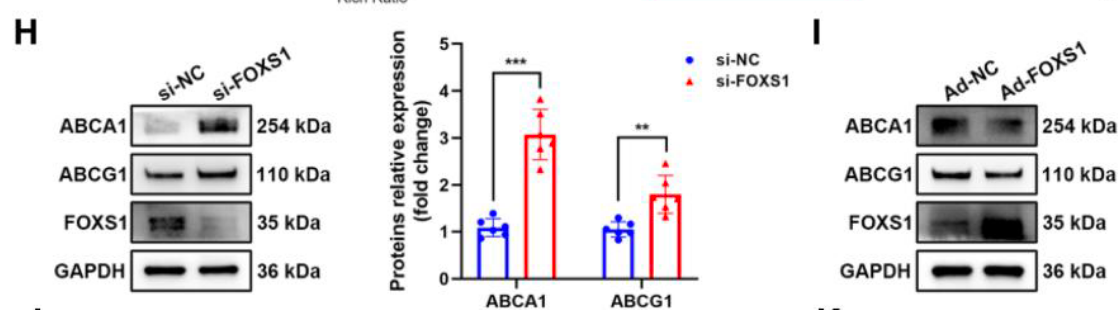
- 靶点验证: Heatmap 和 qRT-PCR 结果锁定 ABCA1 和 ABCG1 为关键下游基因,其表达随 FOXS1 升高而降低 (Figure 4F-4I)。
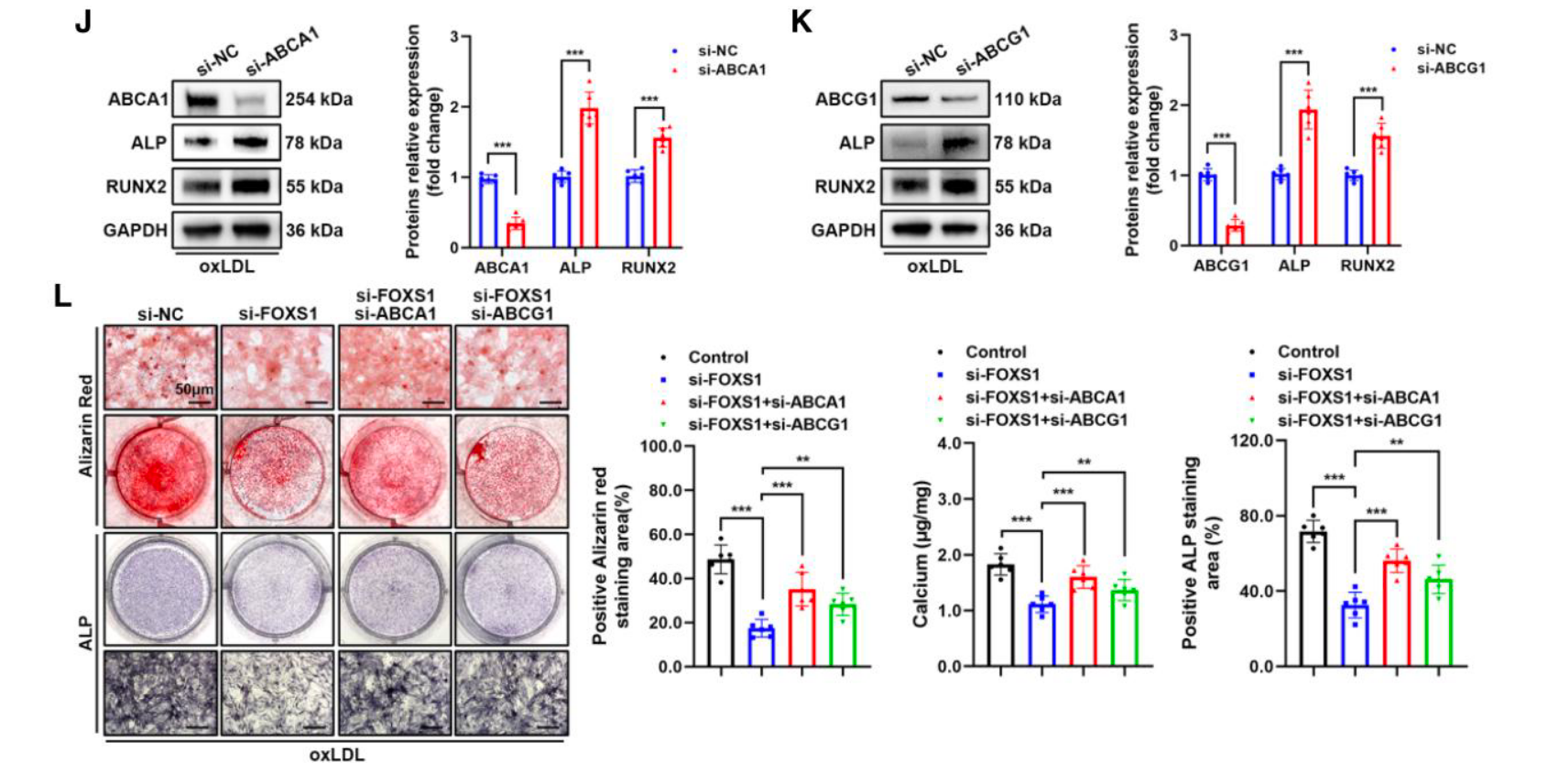
- 功能逆转: 利用 siRNA 敲低 ABCA1 或 ABCG1,发现这会消除敲低 FOXS1 带来的保护作用,使成骨蛋白 ALP/RUNX2 重新升高,并加剧钙沉积 (Figure 4J-4L)。
5. 胆固醇转运障碍驱动 NLRP3 炎性小体激活(机制下游)
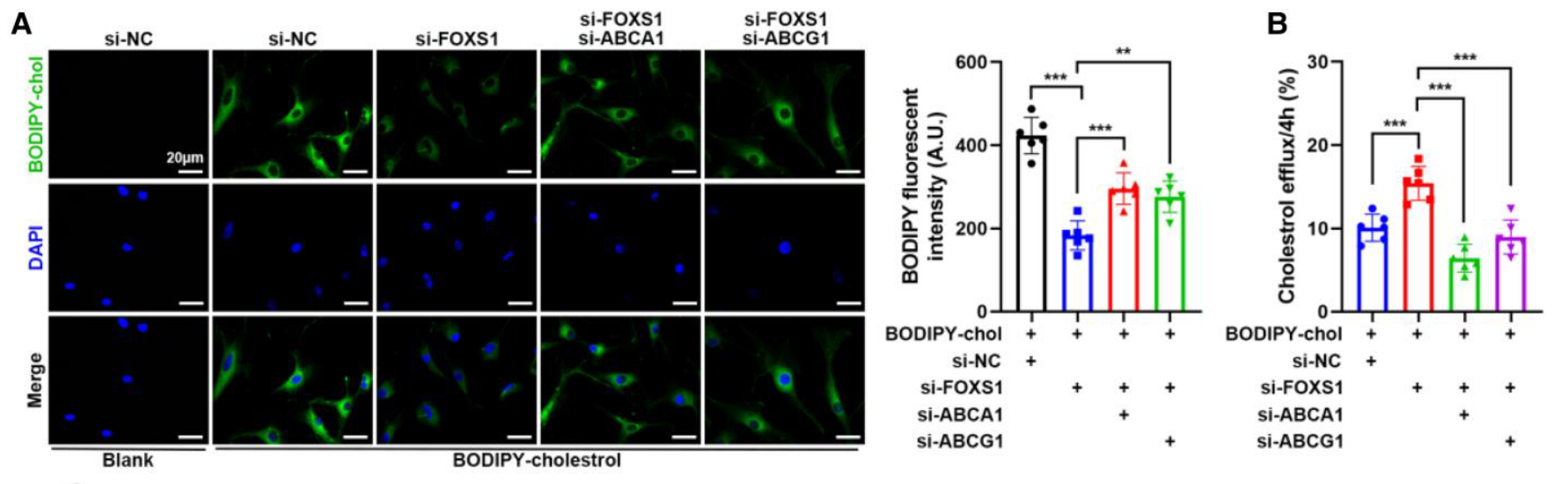
- 利用 Bodipy-胆固醇标记 监测发现,敲低 FOXS1 增加了胆固醇外排并减少了胞内荧光信号,而敲低 ABCA1/G1 会逆转此效应 (Figure 5A, 5B)。
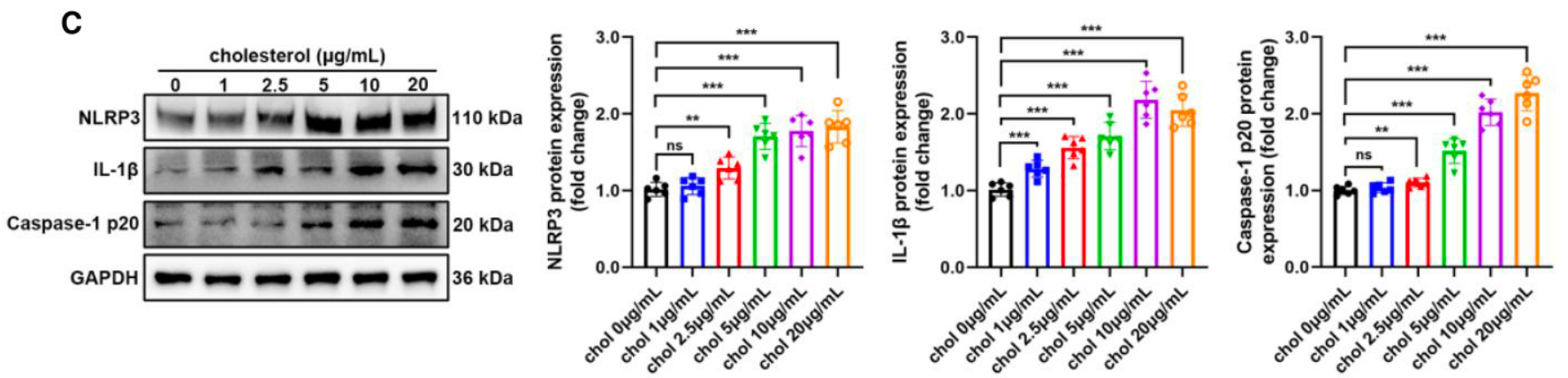
- 炎症诱导: Western blot 证实,增加外源胆固醇浓度会呈剂量依赖性地激活 NLRP3、IL-1β 和 Caspase-1 (Figure 5C)。
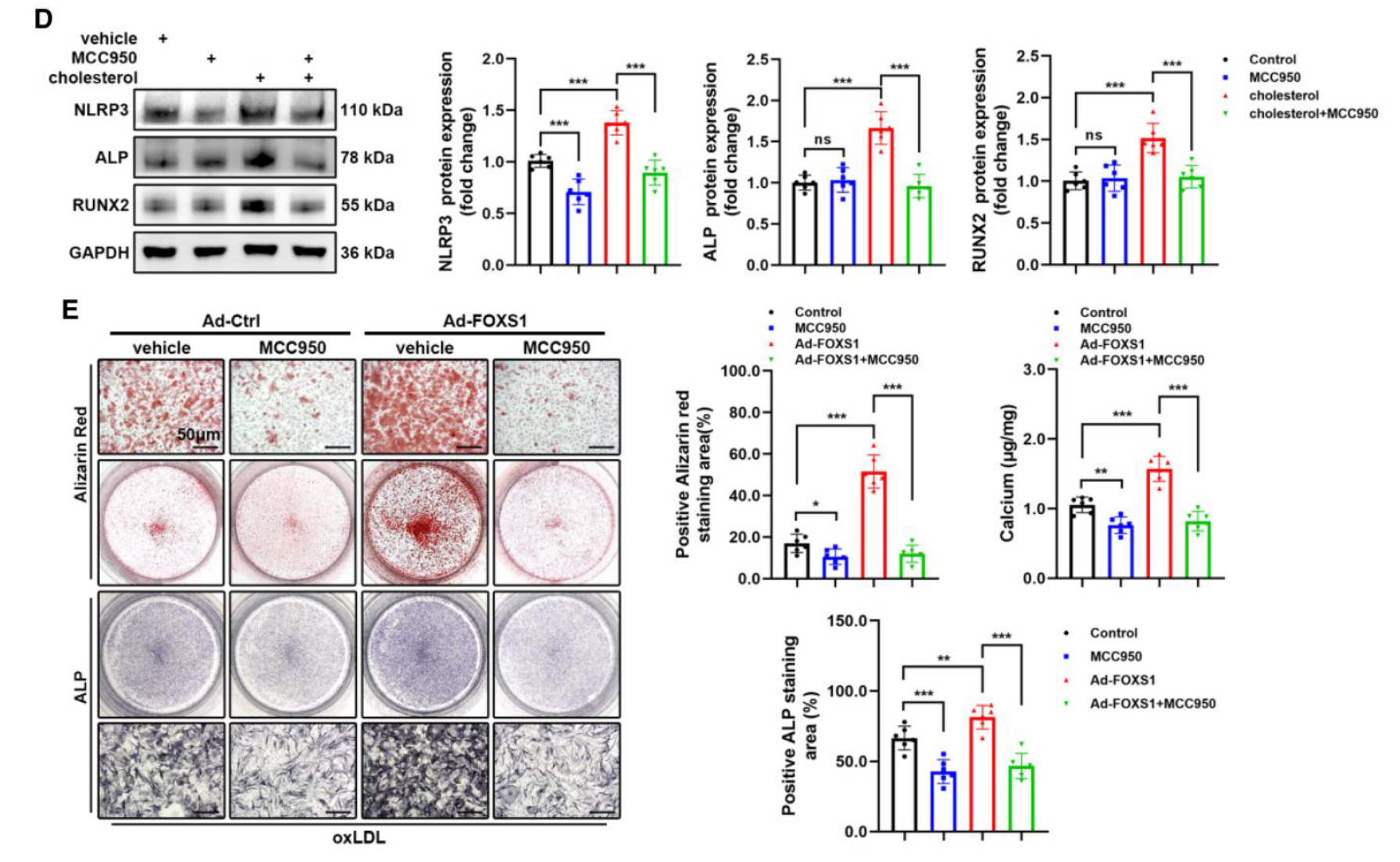
- 抑制实验: 使用 NLRP3 抑制剂 MCC950 处理,可显著阻断由胆固醇或 FOXS1 过表达引起的成骨分化和钙盐沉积 (Figure 5D, 5E)。
6. IMM-H007 通过增加 ABCA1 水平抑制瓣膜钙化 (药物挽救实验)
为了寻找潜在药物,研究者测试了 ABCA1 降解抑制剂 IMM-H007
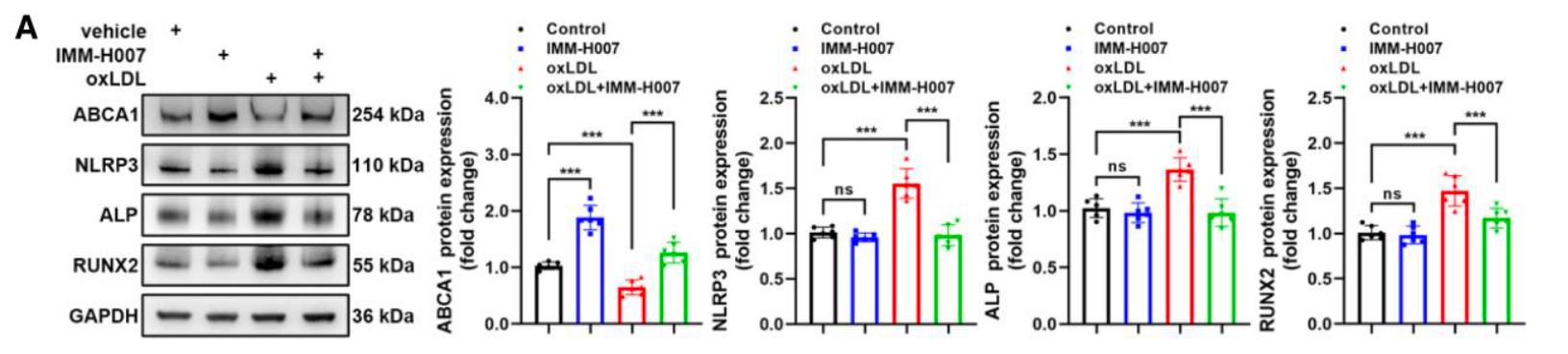
- 体外逆转: Western blot 显示 IMM-H007 能够逆转 oxLDL 引起的 ABCA1 下调及 NLRP3/成骨蛋白的上调 (Figure 6A)。
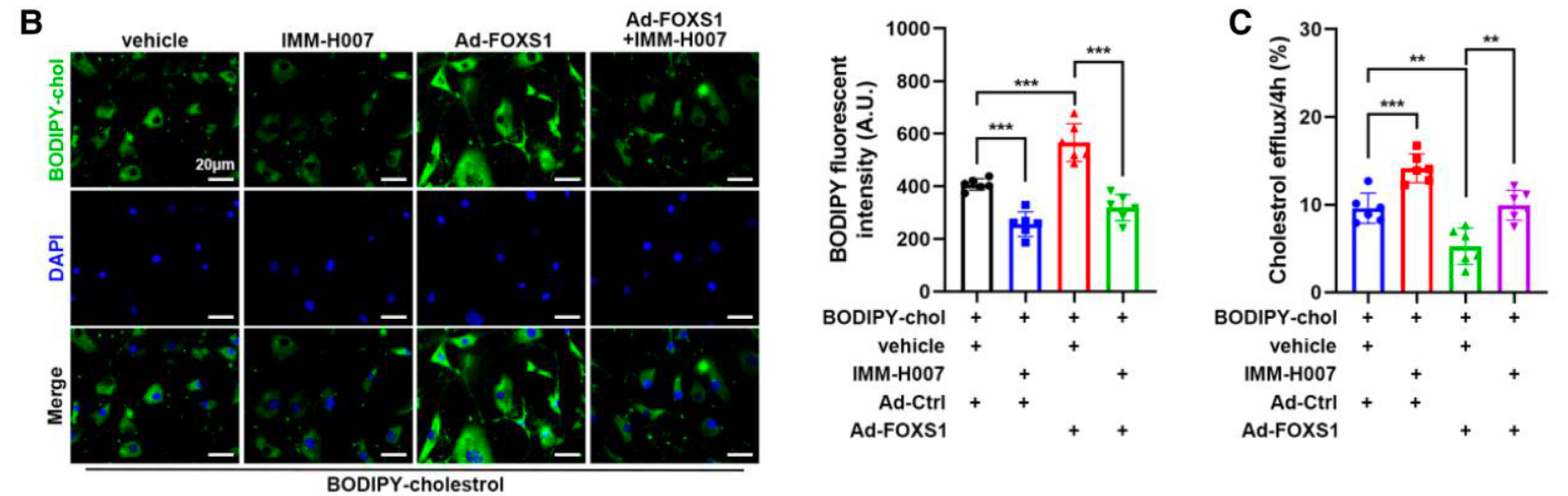
- 转运修复: Bodipy-胆固醇实验 证实 IMM-H007 能在 FOXS1 过表达的情况下恢复胆固醇外排 (Figure 6B, 6C)。
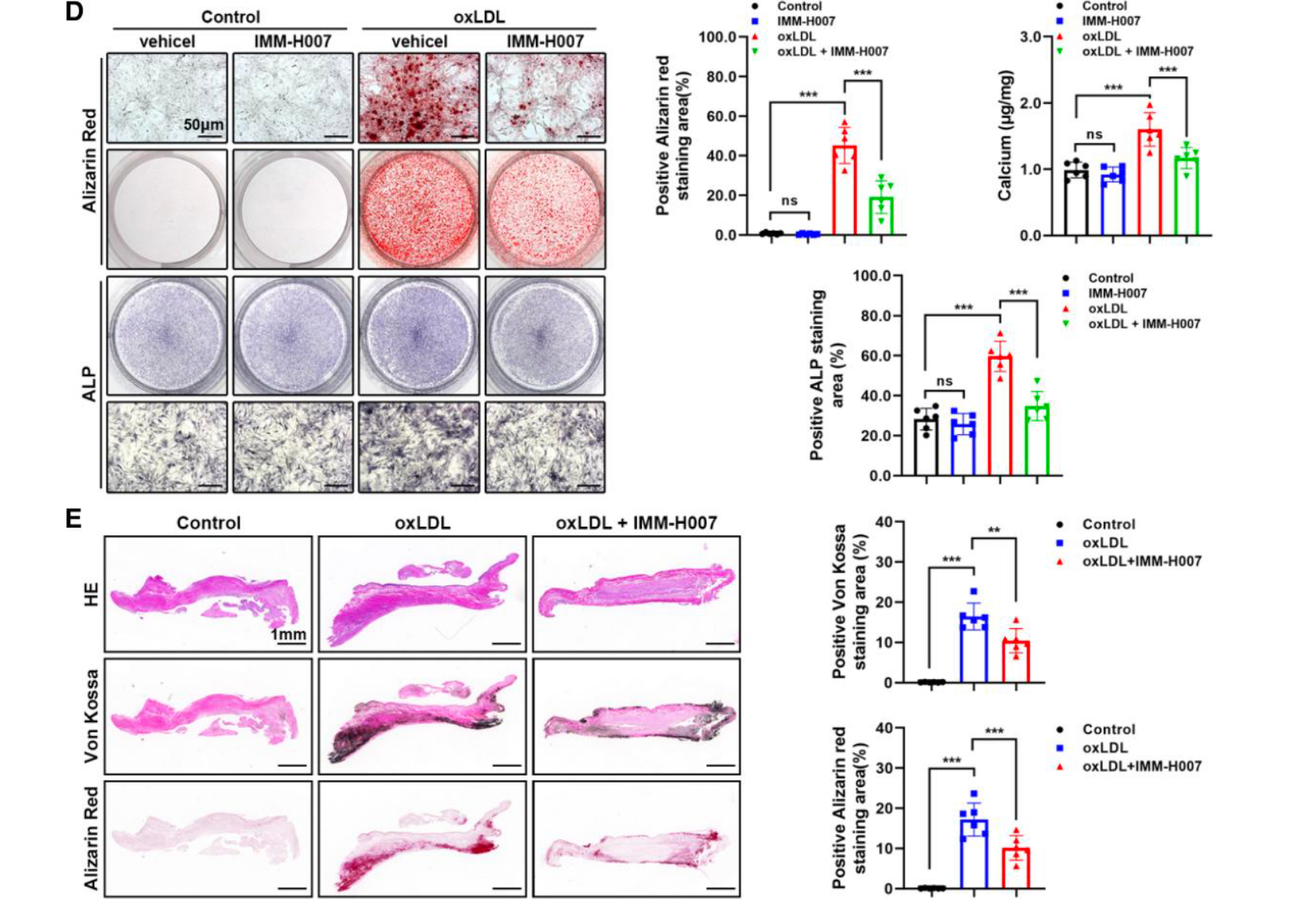
- 表型改善: 该药物显著减少了体外及 离体瓣膜模型 中的钙化结节形成 (Figure 6D, 6E)。
7. FOXS1 通过抑制 BSCL2/PPARγ/LXRα 轴调节转运蛋白 (扣紧机制链条)
研究者通过 ChIP-seq 寻找 FOXS1 的直接转录靶点
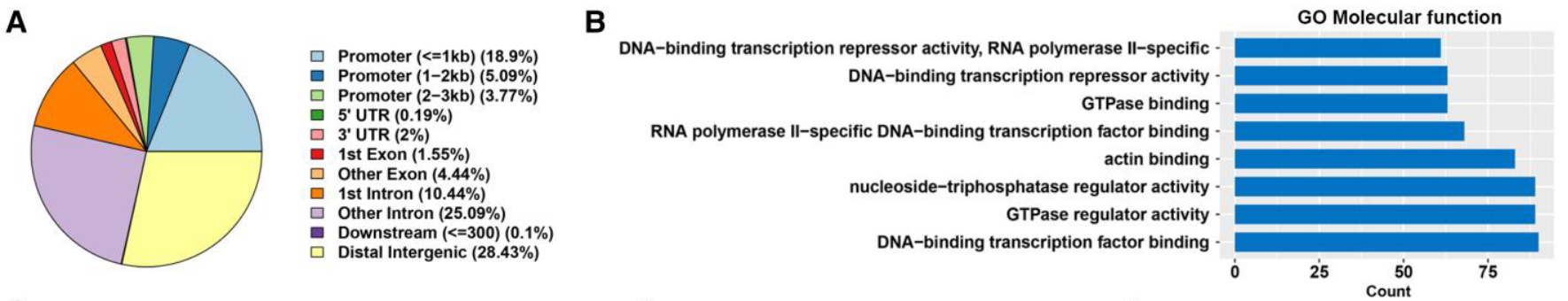
- 结合位点分析: ChIP-seq 描绘了 FOXS1 在基因组的分布,其中 27.76% 位于启动子区 (Figure 7A, 7B)。
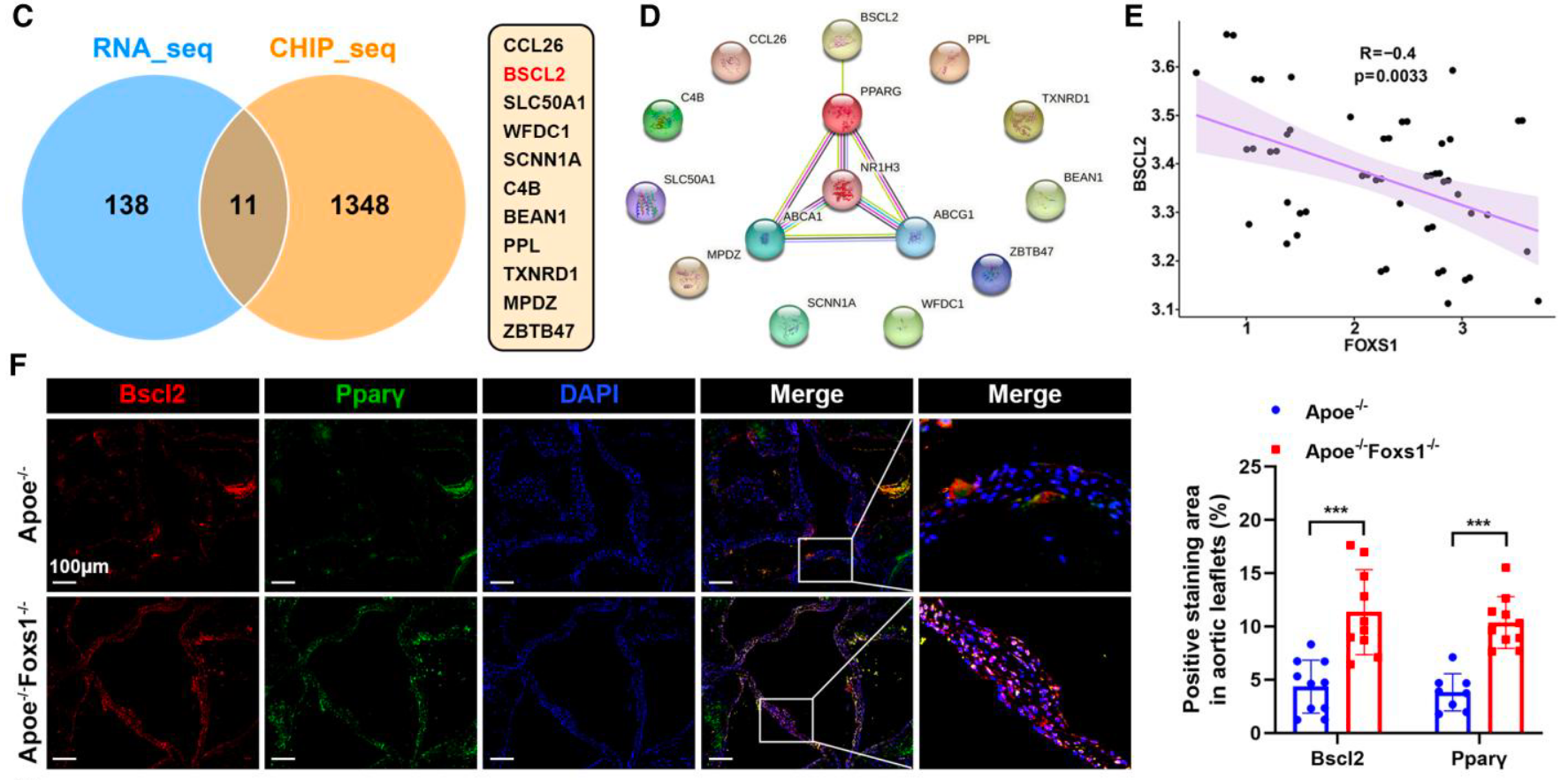
- 核心靶点锁定: 交叉分析 ChIP-seq 与 RNA-seq 数据,鉴定出 11 个核心基因,利用 STRING 数据库 发现 BSCL2 (调节脂质形成和稳态的关键分子)与 PPARγ/LXRα 轴及 ABC 转运蛋白高度关联 (Figure 7C, 7D)。
- 临床与体内验证: FOXS1 与 BSCL2 在瓣膜中呈负相关 (Figure 7E);在 Foxs1-/-小鼠中,IF 观察到 Bscl2 和 Pparγ 的表达显著升高 (Figure 7F)。
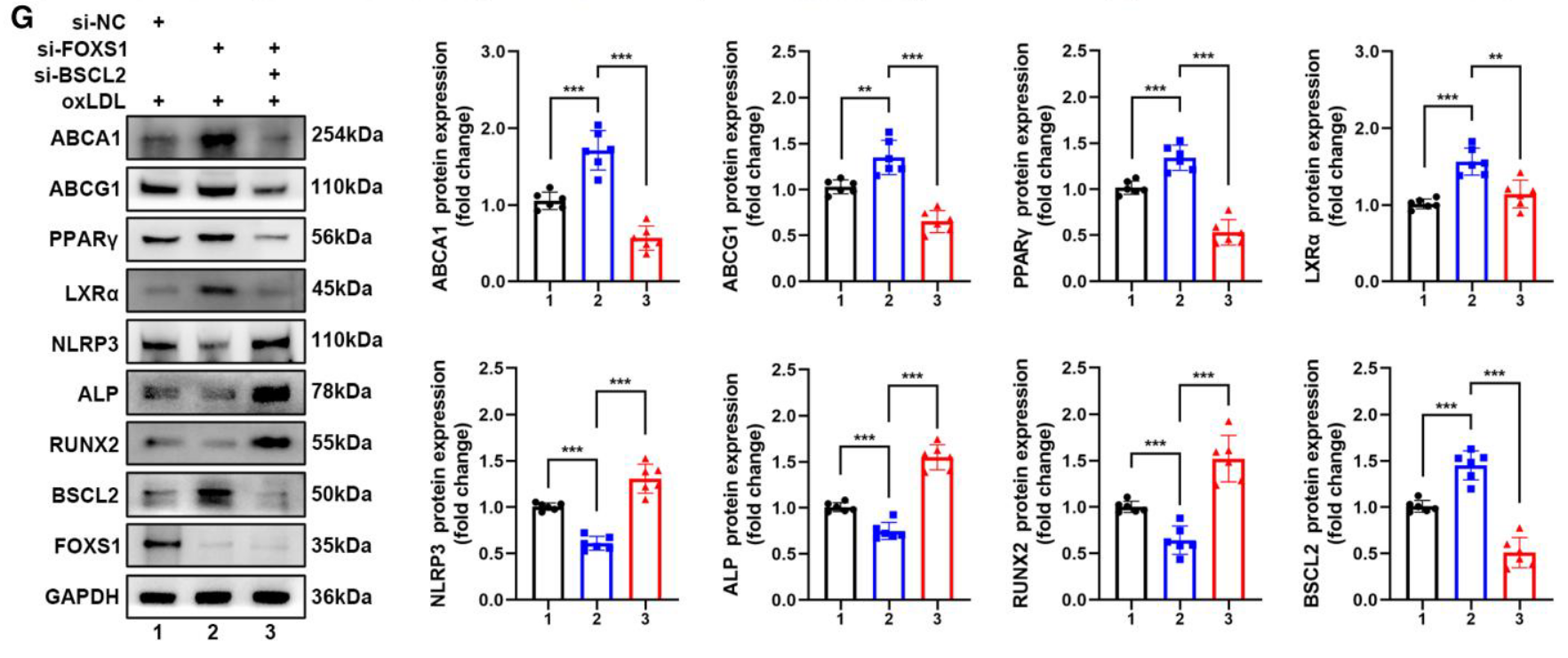
- 信号通路闭环: Western blot 证实,敲低 BSCL2 能够完全阻断由 FOXS1 缺失引起的 PPARγ-LXRα-ABCA1/G1 通路激活及抗炎抗成骨效应 (Figure 7G)。
8. 重组 BSCL2 在体内减轻主动脉瓣钙化
最后,研究者通过腹腔注射 重组小鼠 Bscl2 (rmBscl2) 验证治疗效果 (Figure S20)

- 体内保护: 在 HFD 喂养的小鼠中,rmBscl2 显著改善了瓣膜狭窄指标,并减少了 Von Kossa、茜素红、Masson 及 油红 O(Oil Red O) 染色的阳性面积。
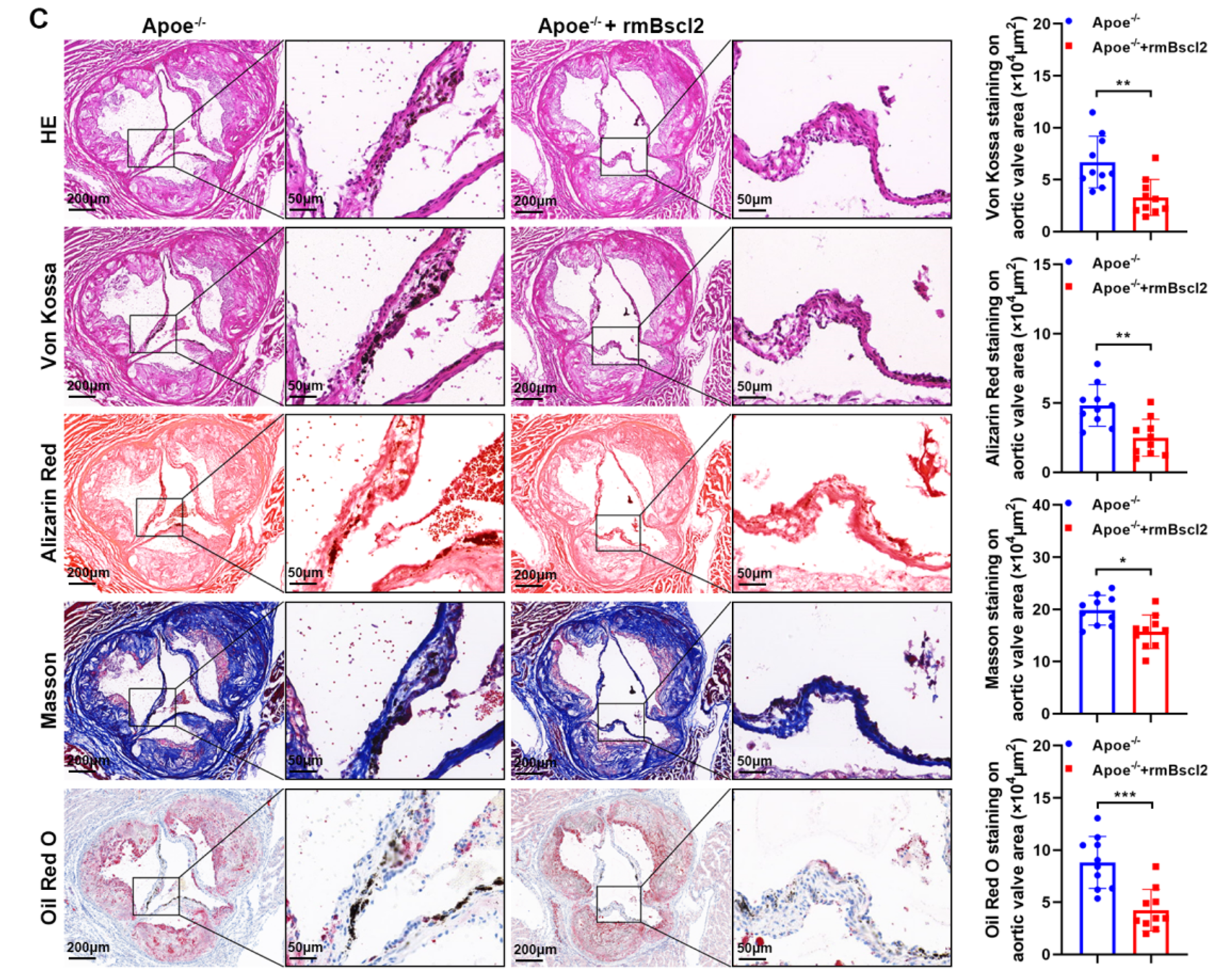
- 机制确认: IF 显示 rmBscl2 提升了瓣膜组织中 PPARγ 和 LXRα 的表达。
讨论
研究创新性
本研究深入探讨了脂质沉积在CAVD早期的作用,揭示了从“脂质沉积”到“成骨分化”的全新分子通路。其创新性主要体现在以下几个方面:
- 首次确立 FOXS1 在心血管领域的致病作用: FOXS1 此前主要在肿瘤学领域被研究,本研究首次证明它是响应 oxLDL 刺激的关键转录因子,在 CAVD 进展中发挥促钙化作用。
- 揭示了瓣膜间质细胞(VICs)独特的胆固醇转运机制: 以往研究多关注巨噬细胞的胆固醇逆向转运(RCT),本研究首次发现 VICs 内部也存在由 ABCA1 和 ABCG1 介导的胆固醇外排机制,且该机制的障碍是导致瓣膜钙化的核心诱因。
- 发现 BSCL2 基因在瓣膜病中的新功能: 研究鉴定出 BSCL2 是 FOXS1 的直接下游靶点。BSCL2 以前多与脂肪营养不良和心脏功能障碍相关,本研究首次将其与 CAVD 联系起来,并明确了 BSCL2/PPARγ/LXRα 信号轴在维持瓣膜脂质稳态中的关键作用。
- 完善了“脂质-炎症-钙化”链条: 研究通过 Bodipy-胆固醇实验直观证明了 FOXS1 导致的转运障碍引发了胞内胆固醇蓄积,进而触发 NLRP3 炎性小体激活,最终驱动成骨分化,为“他汀类药物对 CAVD 获益有限”这一临床现象提供了机制上的合理解释。
研究局限性
-
上游激活机制不明: 目前尚不清楚 oxLDL 究竟通过何种信号通路或受体诱导了 FOXS1 的上调,这一缺失环节限制了对该通路的全面理解。
-
氧甾醇(Oxysterols)的双重作用: oxLDL 中的氧甾醇理论上可以激活 LXR 抑制炎症,但在本研究中,oxLDL 表现为显著的促炎效应,这可能是因为 oxLDL 抑制了 LXRα 的表达,掩盖了氧甾醇的潜在保护作用,其具体平衡机制有待探讨。
-
动物模型与药物转化的差距:
- 本研究使用的是全身性 FOXS1 敲除小鼠,虽然 scRNA-seq 表明 FOXS1 主要在 VICs 中表达,但不能完全排除其他细胞(如巨噬细胞或内皮细胞)缺失 FOXS1 对实验结果的潜在影响。
- IMM-H007 的疗效主要在体外和离体模型中验证,缺乏体内直接针对瓣膜治疗的数据支持。
-
临床转化挑战: 重组蛋白 rmBscl2 的递送方式(如腹腔注射)效率较低,且长期的全身安全性、免疫原性以及在人体的有效性均未得到验证。
思考与见解
- 对“他汀悖论”的深度思考: 他汀类药物主要通过降低循环 LDL 起效,但本研究提示,一旦 oxLDL 沉积在瓣膜内并激活了 FOXS1/BSCL2 轴,仅仅降低血脂水平可能不足以逆转细胞内部已经发生的转运功能障碍。因此,未来的药物研发应从“外部降脂”转向“内部促排”,即通过激活 ABCA1/G1 路径直接清除 VICs 累积的胆固醇。
- 精准医疗的可能性: 研究中提到的 IMM-H007 和 BSCL2 展示了良好的应用前景。未来的方向可能在于利用纳米技术实现药物的瓣膜靶向递送,以减少全身副作用并提高局部治疗浓度。
- 早期预警指标: FOXS1 在 CAVD 患者中的显著高表达,暗示其可能作为一个潜在的生物标志物,用于评估瓣膜钙化的进展风险或作为临床药物筛选的靶点。













暂无评论内容