电镜技术
电子显微镜以电子射线作为照明光源,以电磁场作为透镜,具有高分辨率和放大倍率的显微镜。电镜用于研究组织和细胞的超微结构。
电子与样品作用后产生的电子信号主要有:透射电子和二次电子
透射电子(transmission electron):当样品厚度小于100nm时,部分电子可穿透样品,将穿透样品的电子叫做透射电子,利用透射电子信息成像的称为透射电镜。
二次电子(Second electron):在入射电子的轰击下,样品表面5~50nm深度激发出来的电子称为二次电子,利用二次电子信息成像的称为扫描电镜。
分辨率(resolution):表示人眼和光学仪器能够辨别两点之间最小距离的标志。
电镜的种类:
- 透射电镜
- 扫描电镜
- 高压电镜
- 分析电镜
- 冷冻电镜
透射电子显微镜 Transmission Electron Microscopy

工作原理
- 电子束投射在样品上,部分电子直接穿透样品产生透射电子
- 带有样品信息的透射电子经成像系统放大,投射到荧光屏上
- 透射电子多,荧光屏亮;反之荧光屏暗,荧光屏的亮暗程度与样品微细结构一一对应,产生具有一定反差的黑白影像
TEM的样品制备技术
⭐超薄切片技术 Ultramicrotomy
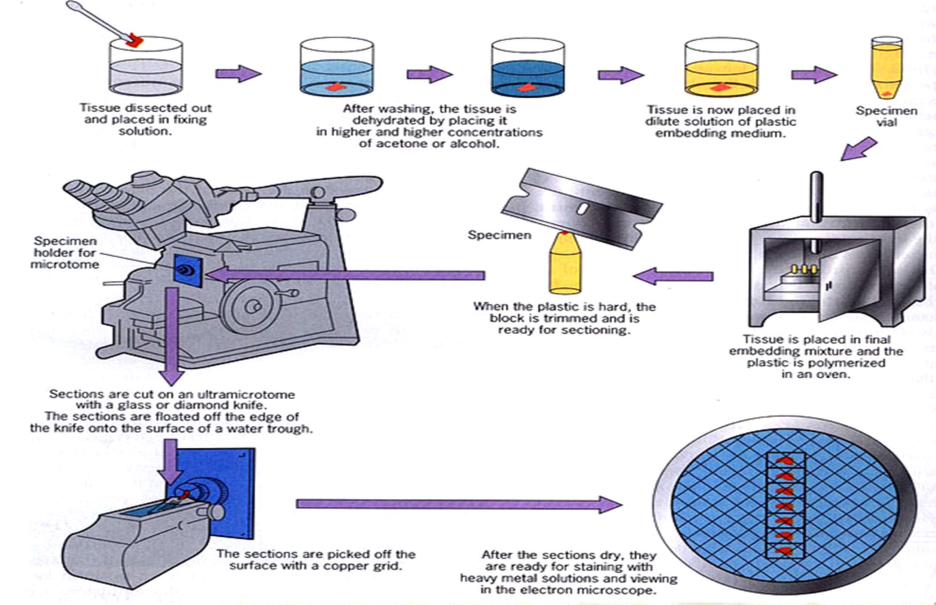
取材→预固定→后固定→脱水→浸透→包埋聚合→修块→切片→染色
⭐取材
取材要点:快、小、轻、冷
- 快:1分钟内固定,尽可能保持其生活状态,因为瞬间的拖延都会导致细胞超微结构的变化
- 小:约1mm³的小块,组织块过大其中央得不到及时固定会发生细胞自溶现象
- 轻:不要牵拉、锯、挤压组织,避免细胞受到损伤
- 冷:低温操作,4℃保存,降低酶的活性,避免组织发生自溶
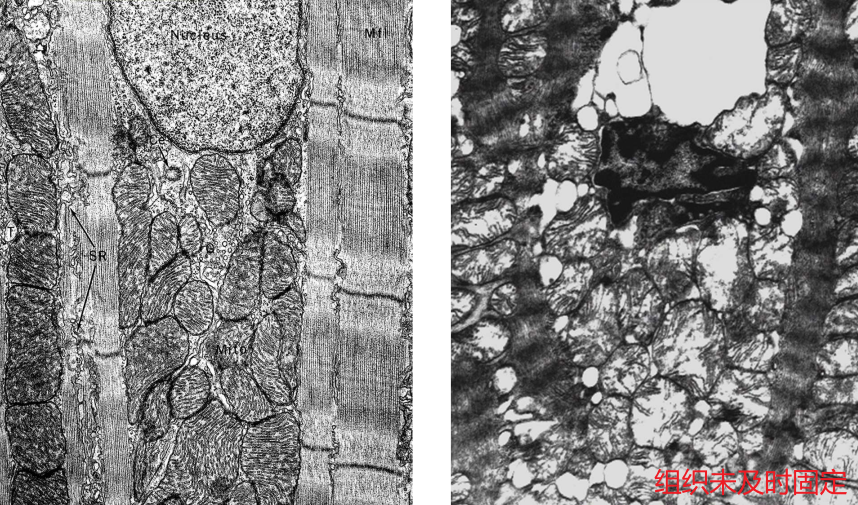
固定:
-
组织块浸泡固定

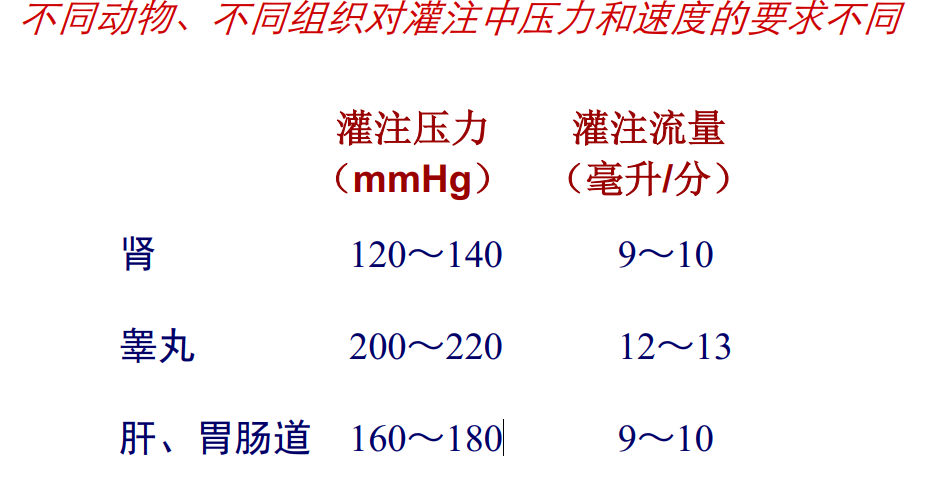
-
血管灌注固定

常用的固定剂:
预固定:1.5 %~5 %戊二醛(0.1M PB配置 )
后固定: 1 %锇酸(四氧化锇)水溶液
脱水:
- 50% 乙醇 10~15分钟,4℃
- 70% 乙醇 10~15分钟,4℃
- 80% 乙醇 10~15分钟,4℃
- 90% 乙醇 10~15分钟,4℃
- 100%乙醇 10分钟,3次,室温
浸透与包埋聚合

将树脂浸透到组织内
切片:
半薄切片(500nm)→ 超薄切片(50~100nm)
为什么要进行半薄切片?
- 选取超薄切片的部位,超薄切片的面积一般小于0.5mm2,要经过半薄切片来选取有意义的部位
- 对同一部位进行光电镜对比观察,可以在较大范围内了解组织结构、病变部位和病理性质
- 用于图像分析,统计学处理
超薄切片:将环氧树脂包埋的组织块切成100nm以下的薄切片称为超薄切片,超薄切片经电子染色后在TEM下观察组织细胞内部的超微结构
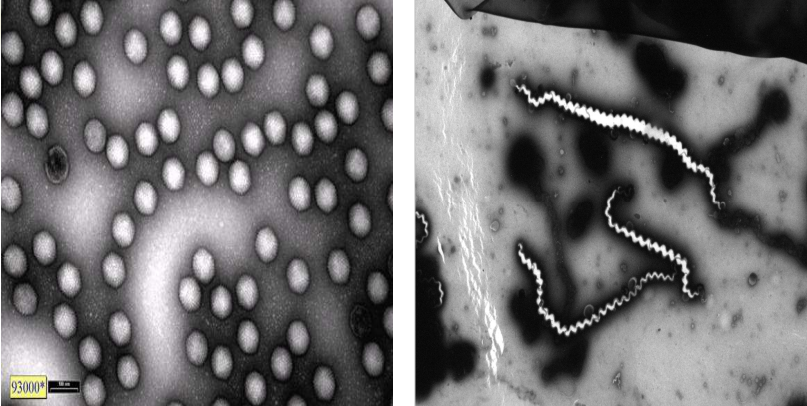
负染色技术 Negative staining technique
通过重金属盐在样品四周堆积,加强样品外周的电子密度,衬托样品的形态和大小
方法:将样本离心悬浮,染色液1~3分钟,电镜观察
应用于:
- 细菌、病毒、噬菌体等微生物大分子结构
- 亚细胞碎片以及分离的细胞器等
- 纳米颗粒
免疫电镜技术 Immune Electron Microscopy
免疫电镜技术是将免疫学方法与电子显微镜技术相结合,利用抗原与抗体特异结合的特性,在超微结构水平定位特异大分子的技术
- 包埋前法:先免疫标记,后包埋、制备超薄切片。适用于抗原暴露在外的情况,如膜外周蛋白 。超薄切片可按常规电镜标本制备技术进行
- 包埋后法:先包埋,制备超薄切片,后免疫标记 。适用于细胞内抗原,超薄切片技术需按免疫电
镜标本制备技术进行 。 - 冷冻超薄切片方法 :冷冻超薄切片机将标本直接切成超薄切片,进行免疫反应,电镜观察 。
TEM在医学领域的应用
-
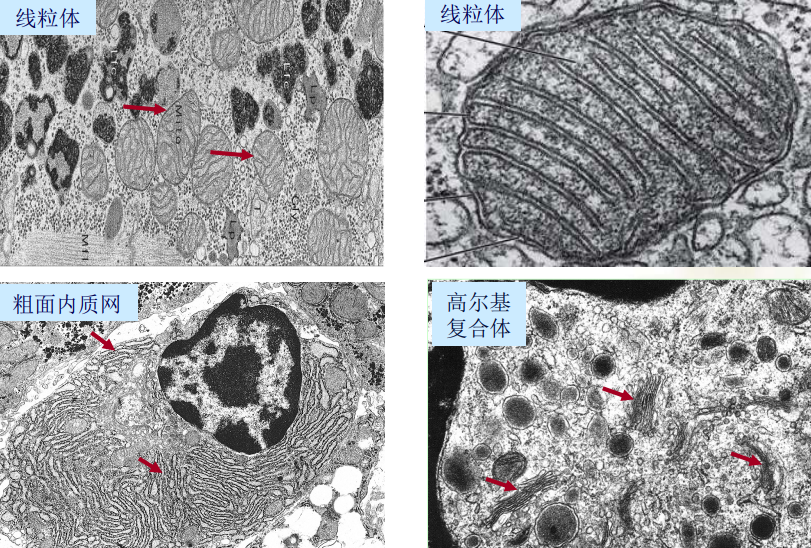
细胞器、组织器官的超微结构

-
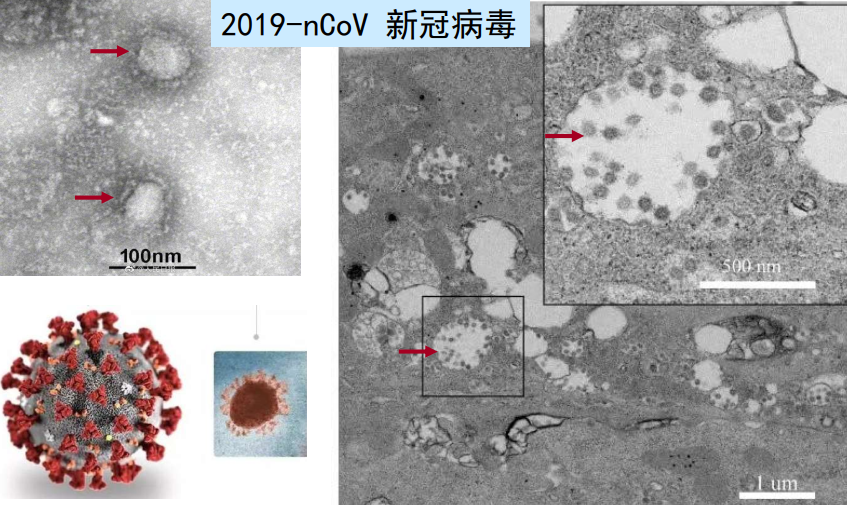
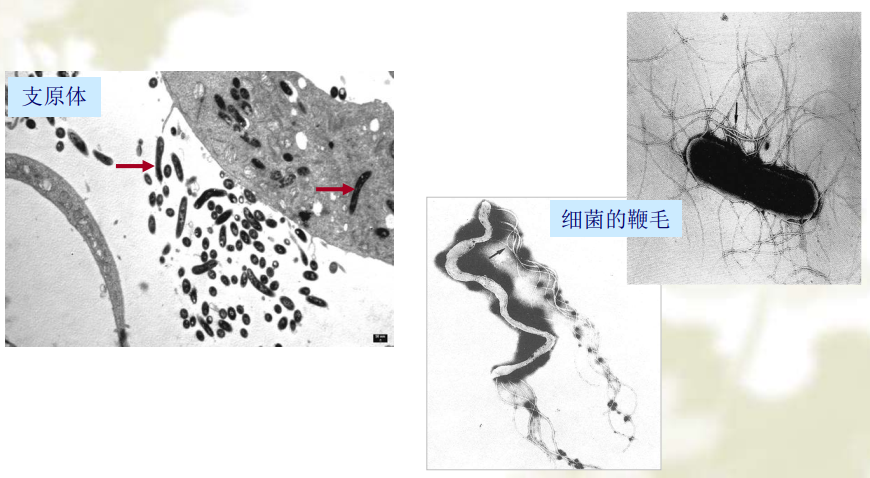
原核细胞、病毒的超微结构

-
原核细胞、病毒的超微结构

-
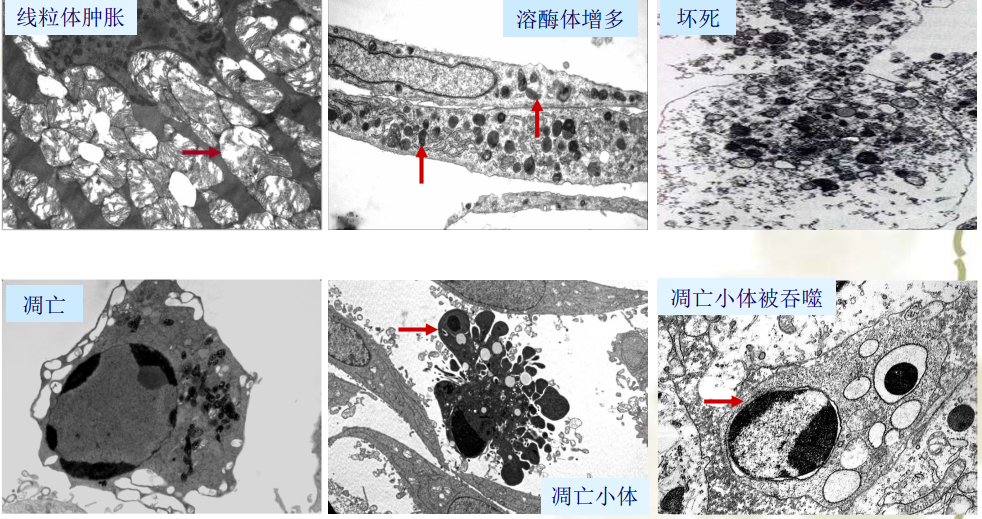
超微病理变化

-
细胞成分的定位
-
生物材料复合体
扫描电子显微镜 Scanning Electron Microscopy
工作原理
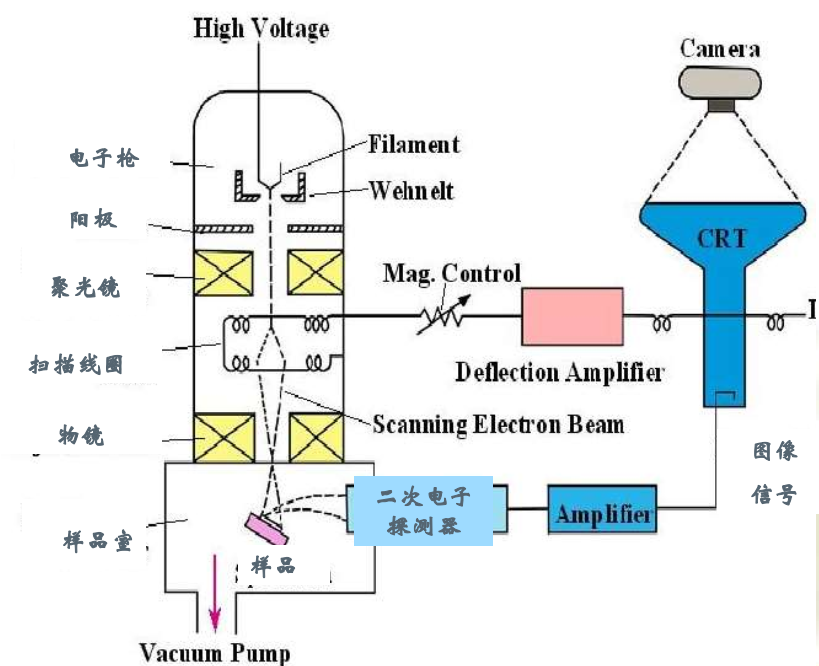
- 电子光学系统
- 信号检测及显示系统
- 电源和真空系统
样品制备
-
取材 充分暴露并保护观察面(5×5mm)
-
清洗 用生理盐水仔细漂洗观察面
-
固定 2.5%戊二醛和1%锇酸固定
-
脱水 丙酮逐级脱水,醋酸异戊酯置换
-
干燥 临界点干燥
-
镀膜 离子溅射镀膜或真空镀膜
-
SEM观察
SEM的应用
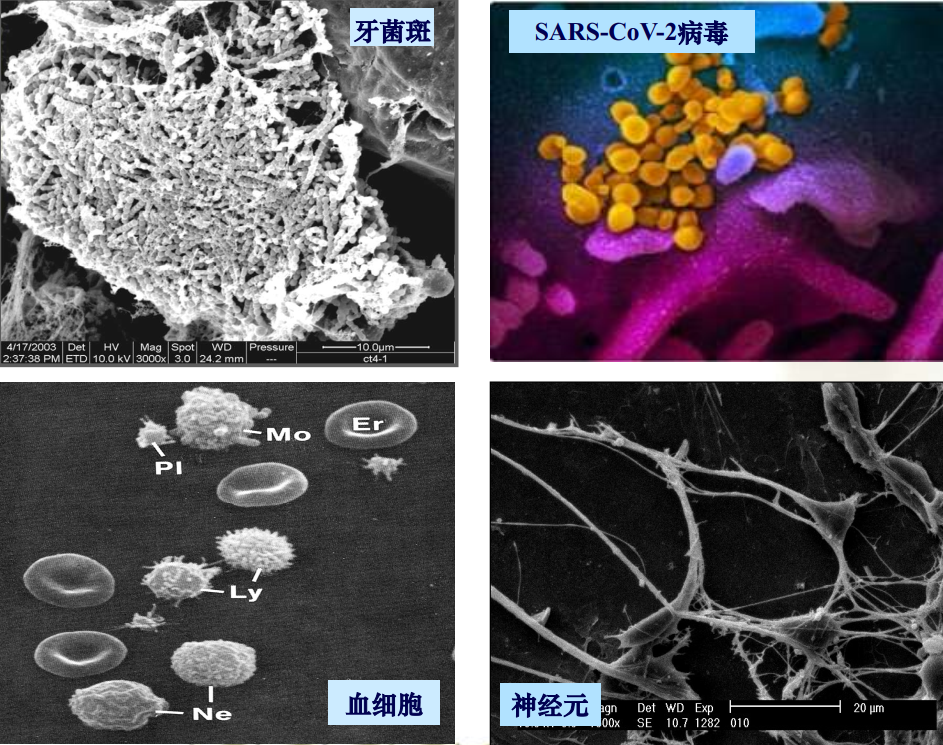
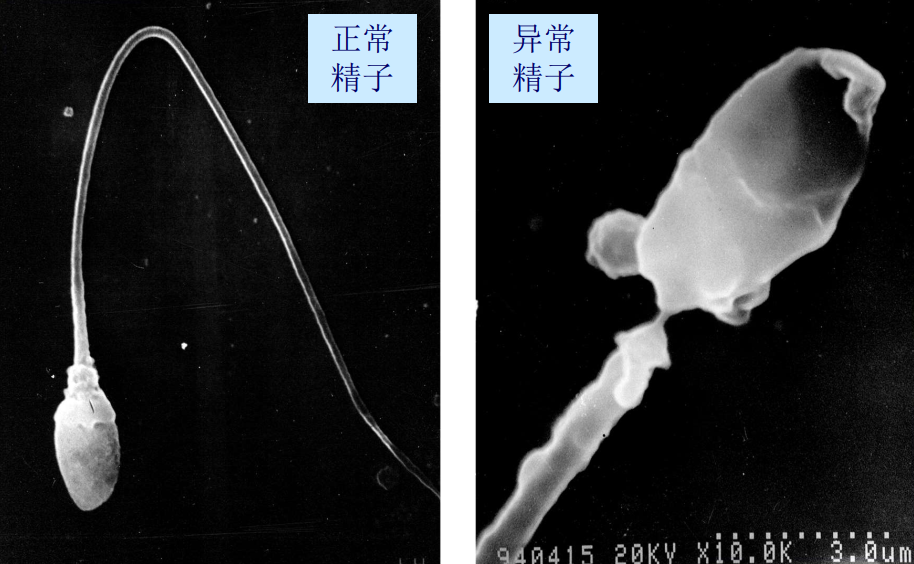
- 细胞、细菌的整体形态、表面突起和细胞间相互关系
- 消化道、呼吸道、血管等空腔组织的表面结构
- 植物、昆虫等
- 生物材料复合体













暂无评论内容