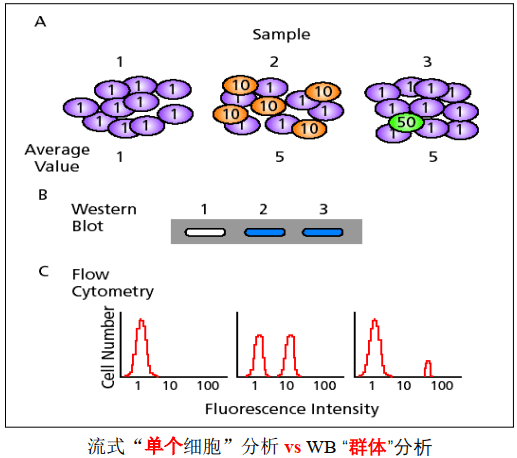
流式细胞术(Flow Cytometry,FCM,FACS)是以流式细胞仪为检测手段的一项能快速、精确的对单个细胞(或生物学颗粒)的理化特性进行多参数定量分析和分选的技术。
流式细胞仪的结构和原理
- 分析型流式细胞仪 Analyzer:细胞样本分析后最终进入废液桶,不能回收利用。
- 分选型流式细胞仪 Sorter:既能流式分析,还能对分析的目的细胞进行分选;进样管道较长,需保持无菌状态,所以分选型流式细胞仪一般只用于分选。

流式细胞术简介
技术特点
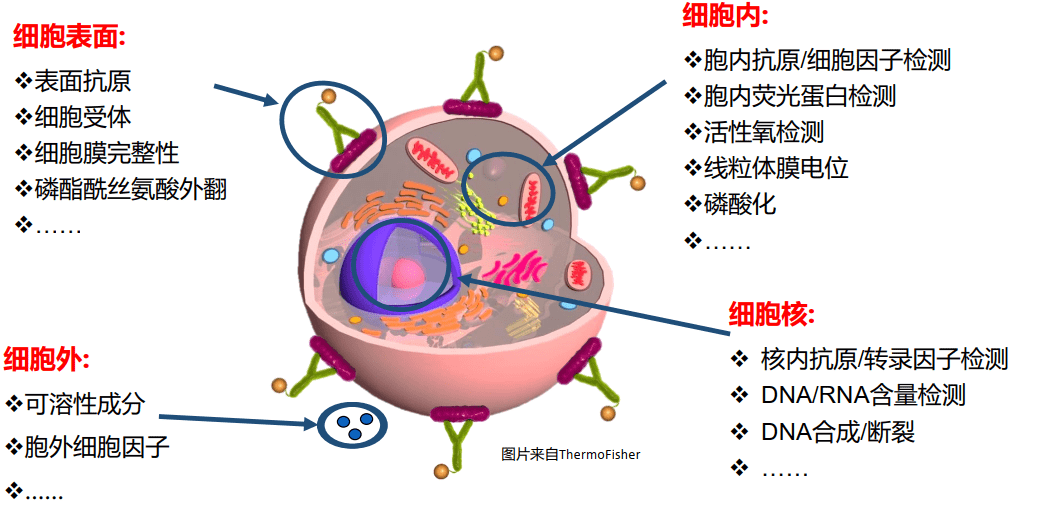
- 检测对象:单细胞或生物颗粒(0.2-50μm);
- 检测参数:多参数;
- 检测特点:单细胞水平分析;
- 检测速度:高速,最高达几万个细胞/秒;
- 检测结果:精度高、准确性好;
- 可对目标细胞进行分选。
流式细胞仪的构成
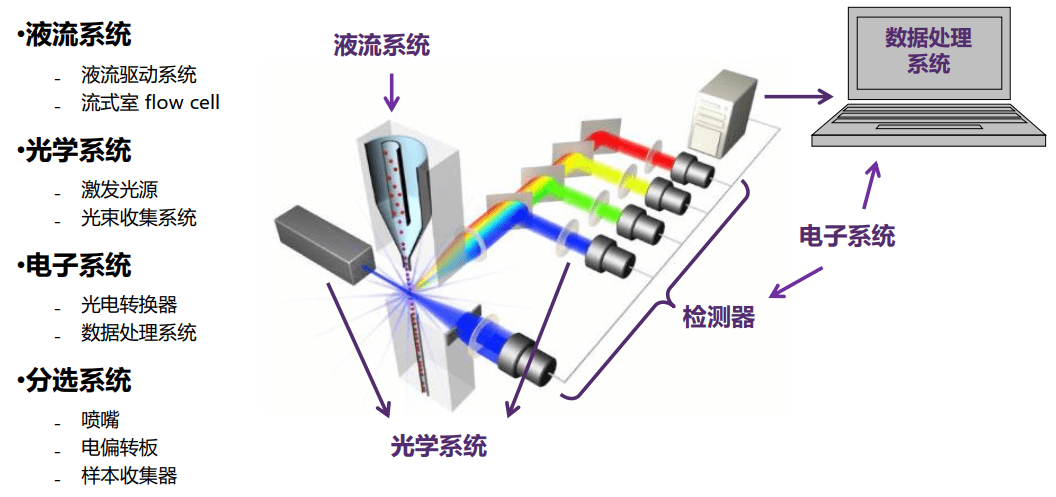
液流系统
形成稳定的单细胞流,并起清洗作用。
- 鞘流技术:根据层流原理发展起来的技术,可以实现两种液体的同轴流动,样本细胞流位于轴心稳定流动,外面包裹有鞘液(sheath)。
- 流体动力学聚焦:稳定的液流从截面积较大的部分流入截面积较小的部分后,有一个聚焦收缩作用,细胞流直径被约束在10-20μm,避免了多个细胞重叠进入检测区。
- 流动室(flow cell, flow chamber),被称为单细胞发生器,是流式细胞仪的核心部件。流动室中,被测细胞逐个通过,并在此与激光聚焦。
光学系统
提供单细胞照明光源,激发并收集特定波长的光信号。主要由激光器、光束分离和收集系统组成。
- 激光器:单波长、高能量、小发射角、高稳定性光照。
- 流式仪器中常用的激光器:
488nm 蓝色激光器
640nm 红色激光器
405nm 紫色激光器
561nm 黄色激光器
355/375nm 紫外/近紫外激光器
532nm 绿色激光器
电子系统
将光信号转变成电子信号,并数字化以供计算机软件系统分析。
- 光电检测器(通道):光电二极管(photodiode) 、光电倍增管(photomultiplier, PMT)
光信号检测
散射光信号
与标记荧光素无关,是细胞的固有参数。
-
前向散射光(forward scatter, FSC):信号方向与激光束平行,偏离度一般在1-6度范围内,亦称小角度散射光,主要反映被测细胞的体积大小和活力。
-
侧向散射光(side scatter, SSC):信号方向与激光束和液流形成的平面相垂直,亦称90度散射光,其信号强度反映细胞内部颗粒度和精细结构的变化。
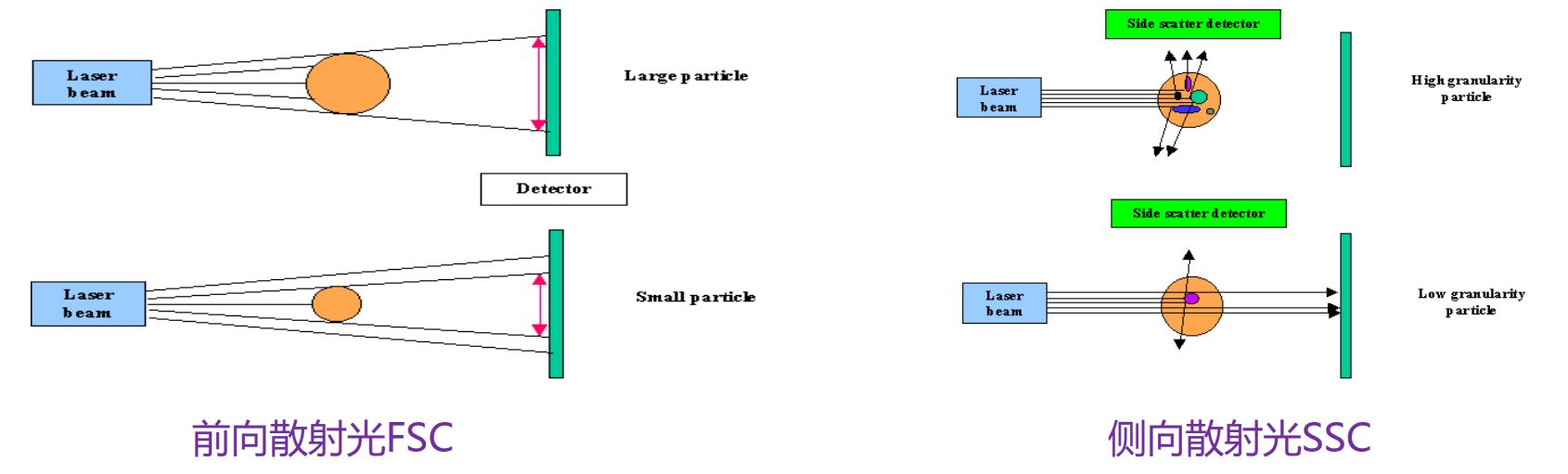
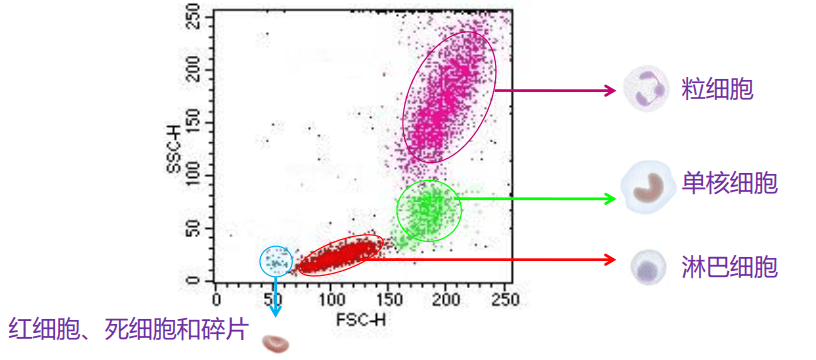
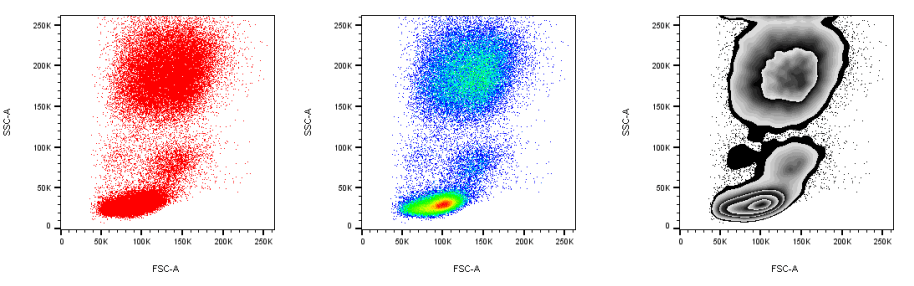
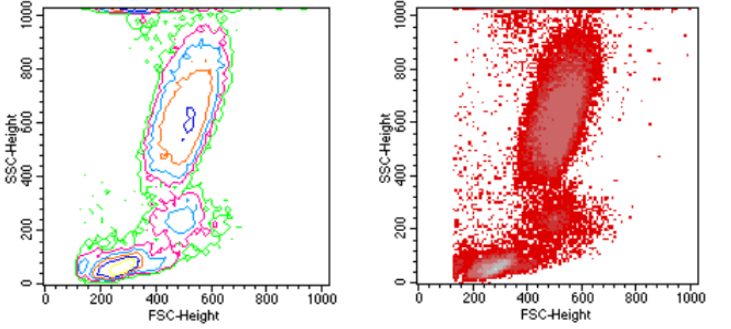
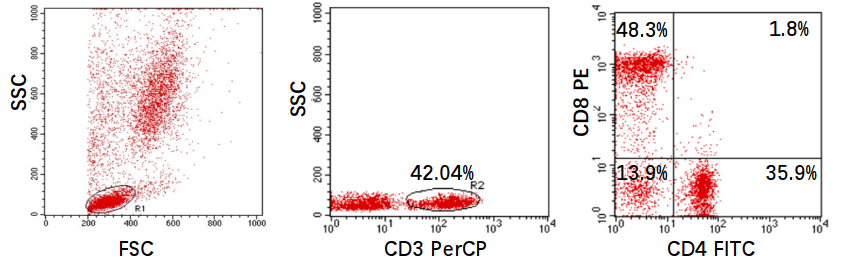
实验中,常利用FSC和SSC这两种参数的组合,区分不同的细胞群体,去除碎片、死细胞和粘连细胞的干扰。如人外周血裂解红细胞后流式检测,FSC/SSC散点图:
荧光信号
荧光基团吸收光的能量由低能状态转变为高能状态,再回到低能状态时释放出的光
- 自发荧光 :微弱
- 特异荧光:标记的荧光素分子发出的荧光,比自发荧光强很多倍
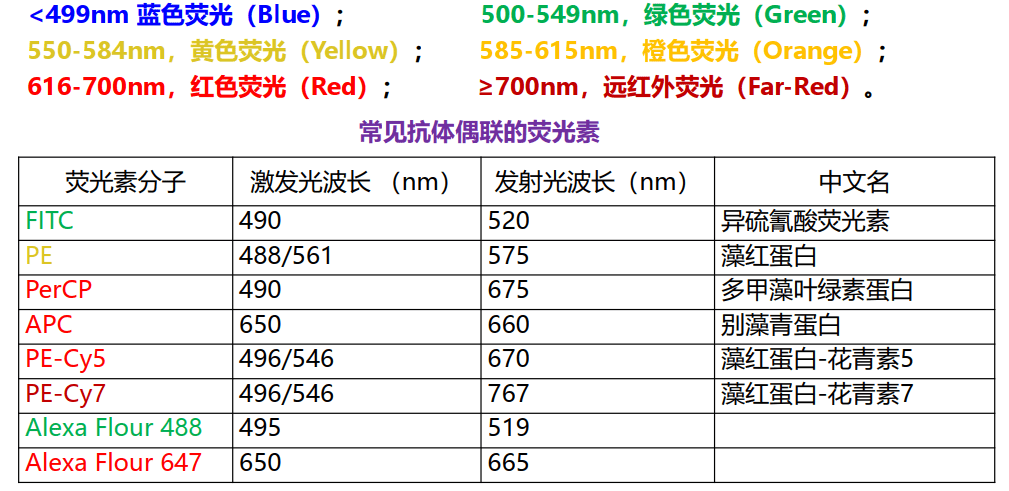
常用的核酸染料:
- PI(碘化丙啶 535, 623)可以插入核酸双螺旋碱基对中而发光,常用于DNA分析;PI不能透过活细胞膜,常用于鉴定死细胞。
- 7-AAD(7-氨基放线菌素D 545, 647 ) 以插入的方式与DNA链的G-C碱基对结合,不能透过活细胞膜,常用于鉴定死细胞。
- DAPI(4,4,6-二脒基二苯基吲哚 358, 456) 可以非嵌入方式与DNA链上的A-T碱基对特异性结合。变异系数明显小于其他染料,一种理想的DNA定量染料。
- Hoechst(343, 450)常见为Hoechst33342和33258,非嵌入的方式与DNA链上的A-T碱基对结合。能对活细胞染色,用于活细胞DNA定量分析,如精子分选;还用于侧群细胞的分选。
- PY(派若宁 560, 573) RNA染料,能进入活细胞。
- AO(吖啶橙 509, 525) DNA、RNA染料,染色后DNA呈黄绿色荧光,RNA呈橙黄色荧光,可进行DNA/RNA双参数分析。
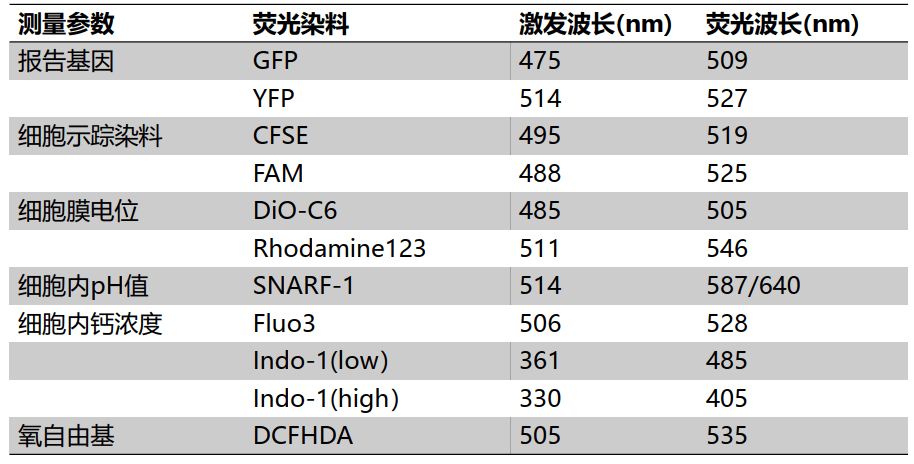
其他荧光探针/蛋白
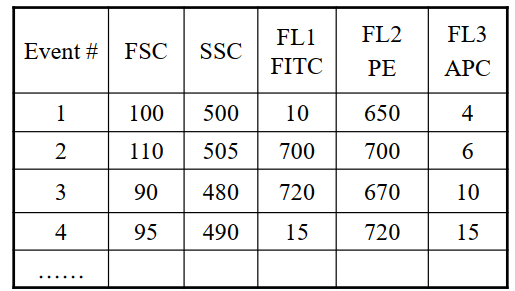
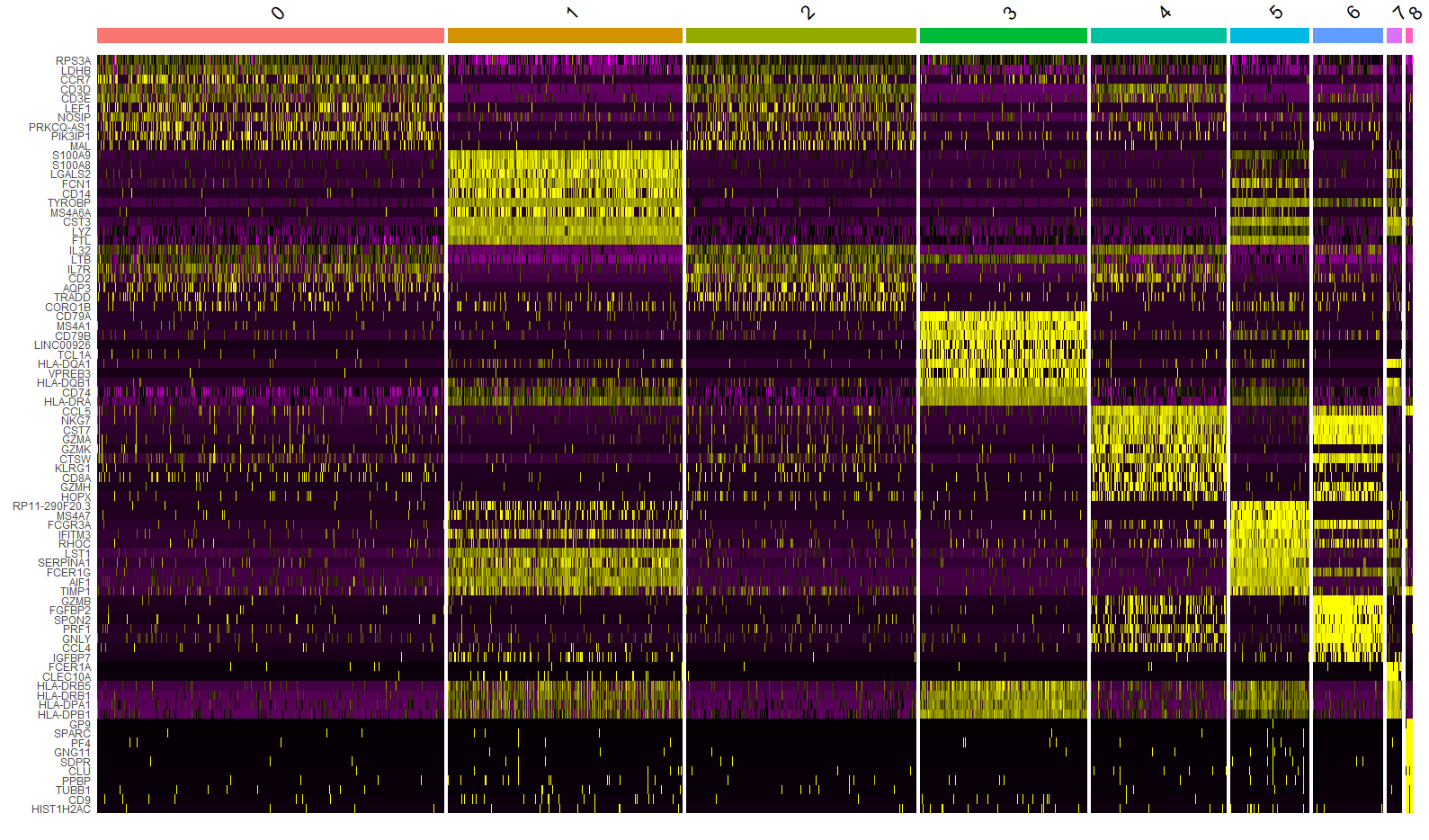
流式数据存储、显示和分析
流式的原始结果为fcs后缀的文件,记录了每个细胞的所有参数的信息、以及时间、仪器参数等信息
直方图
细胞的某一单参数数据的统计分布图,横坐标表示荧光信号或散射光信号相对强度
的值,单位是道数,纵坐标一般是细胞数。
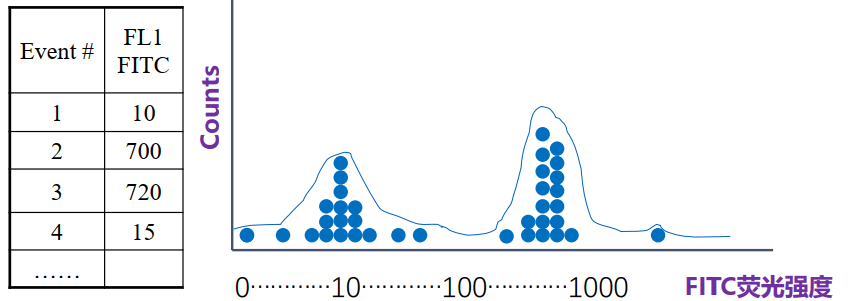
既可以是单个的样本,也可以是多个标本的叠加overlay。峰越靠右,代表光信号越强,表达越高。
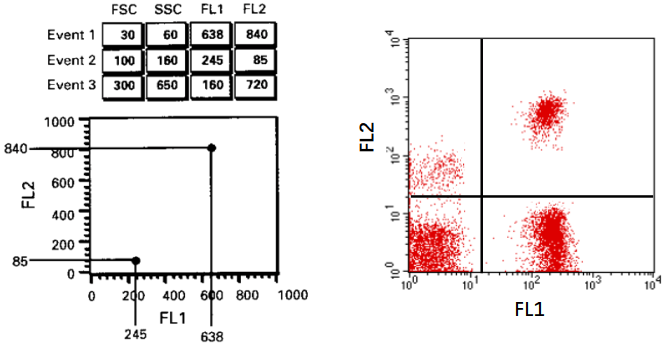
散点图
散点图中每个点代表一个细胞,X轴与Y轴分别代表一种参数,优点是比直方图直观。
散点图、伪彩图、斑马图
等高线图、密度图
等高图:类似于地图中的等高线,同一条线上的细胞数目相等,越在里面的曲线代表细胞数目越多。
密度图:点密度越大的地方细胞越多,点密度越小的地方细胞少。
假三维图、三维图、 t-SNE降维图
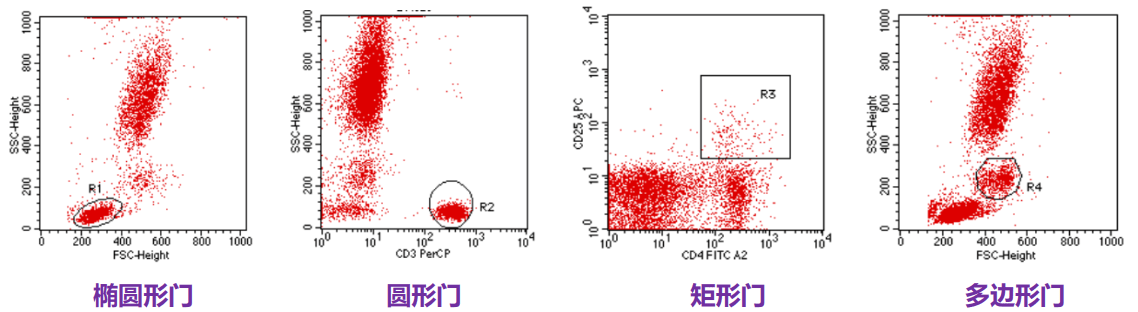
设门与数据分析
门(Gate)是流式细胞术中的一个重要术语,FCM数据分析过程实际上就是选门和设门的过程。
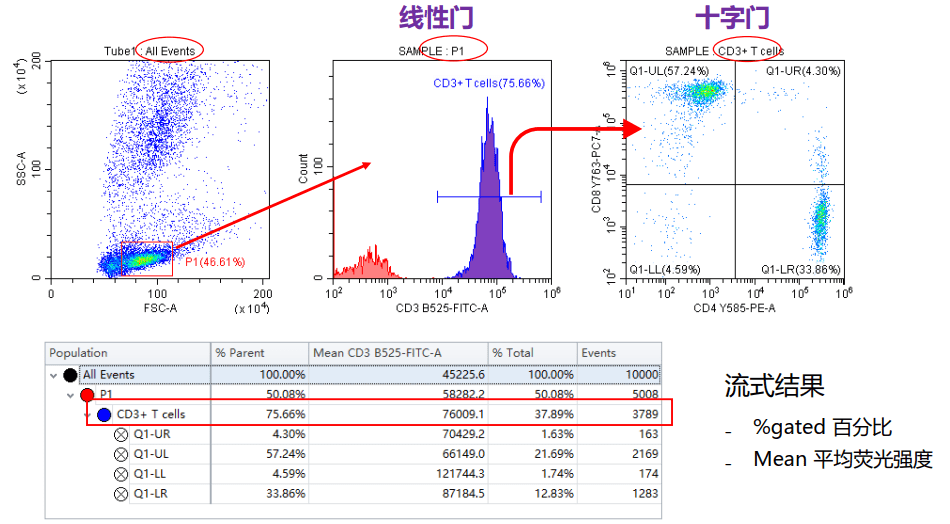
流式图中的坐标轴
通过软件,坐标轴的范围可以修改,让细胞群体位于图形的中间位置。
坐标轴Scale:
- Lin 线性,一般FSC/SSC或者周期倍体检测时选择lin;
- Log对数;一般荧光信号选择log,散射光检测微颗粒时也可选择log;
- Logicle(Biex)双指数 ,能显示0及以下的数据,低位段时为lin scale,高位段时log scale。
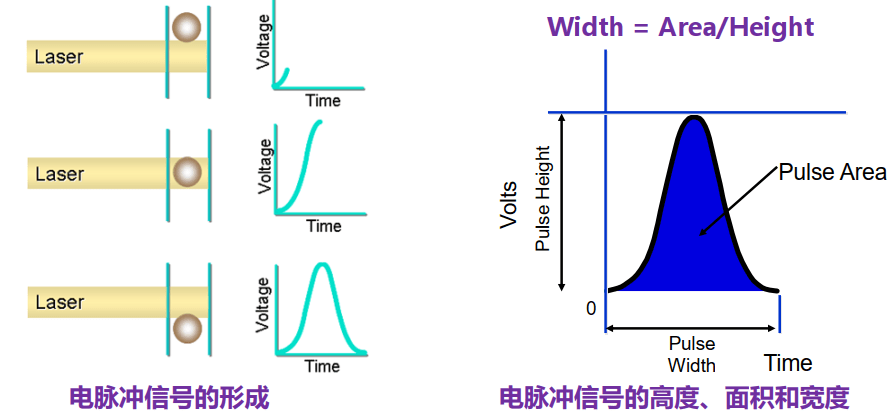
面积Area/高度Heigh/宽度Width参数
A/H/W参数的组合,可用于黏连细胞的去除
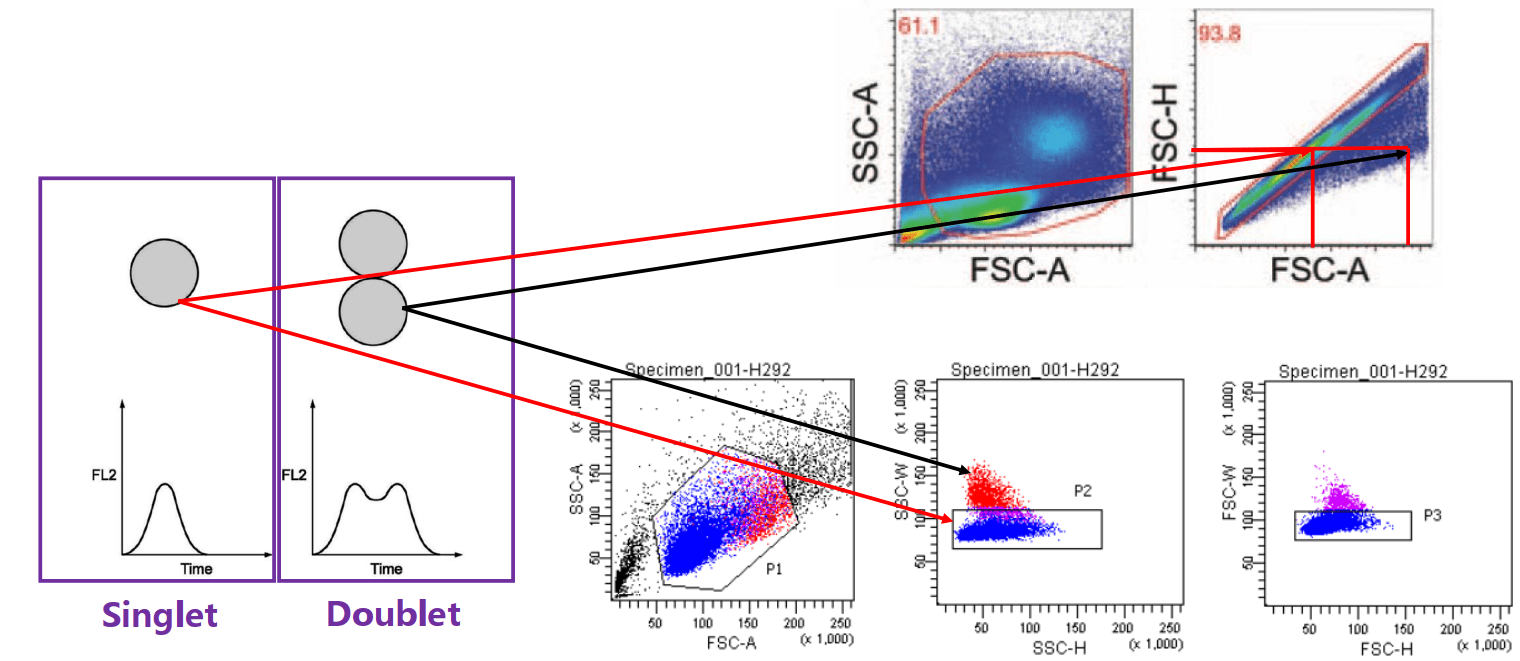
黏连细胞的去除
黏连细胞Doublet的W信号较大;A/H组合图,黏连细胞会偏离对角线。
流式细胞术的操作与技巧
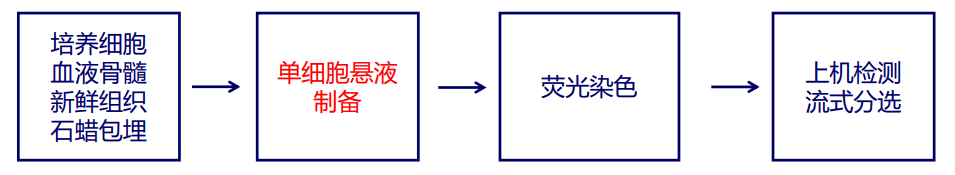
⭐单细胞悬液的制备
- 培养的细胞:贴壁的细胞直接消化、悬浮细胞吹打混匀。
- 血液或骨髓:溶血素裂解红细胞、淋巴细胞分离液分离。
- 组织:肿瘤组织、皮肤、脐带、小鼠的脾脏、肺脏、肠道等
血液、骨髓标本样本制备
密度梯度离心分离PBMC
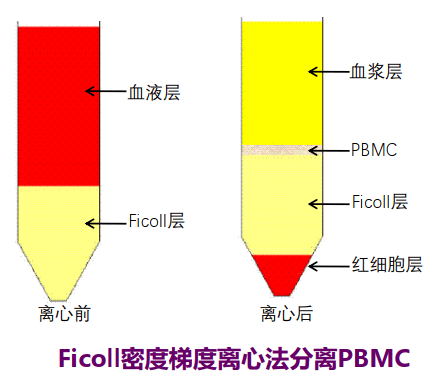
由于多核粒细胞比较大,粒细胞沉降在红细胞层,所以该法不适合粒细胞研究;
该法操作过程中可能丢失一些有意义的细胞或细胞亚群,所以临床上一般不主张分离血液或骨髓的单个核细胞。
溶血/裂解法
原理:红细胞裂解液成分为低渗的NH4Cl溶液,利用双凹型的红细胞膜抗性差,白细胞膜抗性比较好的特点,加入低渗透压的红细胞裂解液时,红细胞膜胀破,而白细胞膜不受影响,从而达到去除红细胞的目的。
临床上应用溶血/免洗(lyse/no wash)技术,既简化了操作步骤,又避免了洗涤过程中可能造成的某些亚群细胞的丢失。尤其在检测严重污染性标本时,避免了因离心等处理可能导致气溶胶产生引起病毒感染的可能。
新鲜实体组织的流式样本制备
对于不同组织来源的实体组织和实体瘤标本,应该根据各自特点选择不同的分散细胞方法,以期达到单细胞产量高、损伤小、杂质少的目的。常用方法有:
-
机械法:剪碎法、网搓法、研磨法等。利用机械方法、物理方法给予组织较大的压力,使细胞从组织间分散开来。同时尽量增加酶或化学试剂与标本接触的面积。
-
酶消化法:酶解细胞外基质以及细胞之间的连接,根据分散组织类型来确定使用的酶类包括
- 胰蛋白酶—水解酯键、肽键;
- 胶原酶—降解几种分子类型的胶原;
- 溶菌酶—水解糖蛋白、肽的糖苷键;
- 弹性蛋白酶—消化糖蛋白、弹性蛋白的纤维;
- 透明质酸酶
-
化学试剂处理法:将组织细胞间起黏着作用的钙、镁离子置换出来,从而使细胞分散开来,常用试剂有EDTA、EGTA、TPB等。EDTA是一种螯合剂,可以和组织间的钙、镁离子形成螯合物,实际运用中常采用螯合物加酶法(主要是胰蛋白酶)
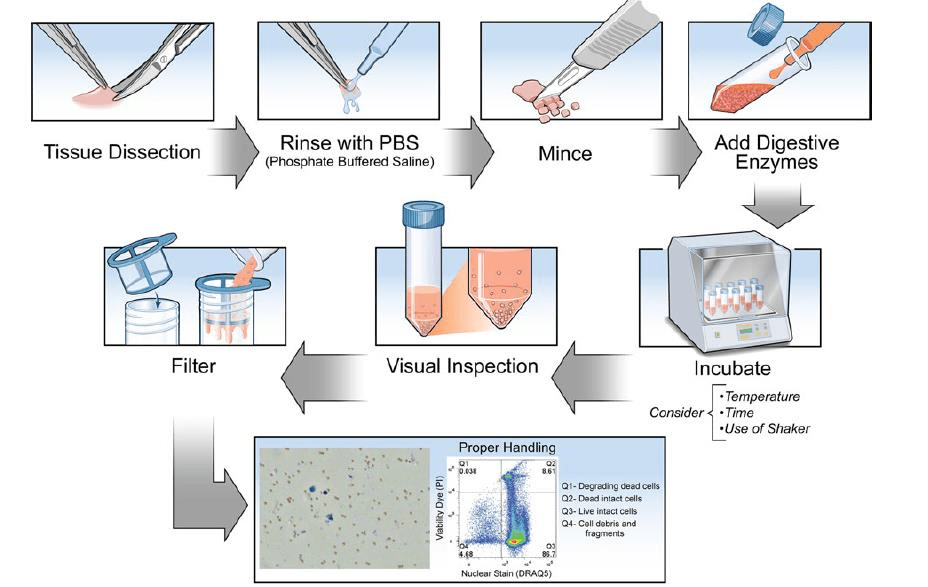
实际工作中经常是三种方法配合使用,应根据实验目的不断优化条件。
组织标本需过滤后上机。
荧光染色
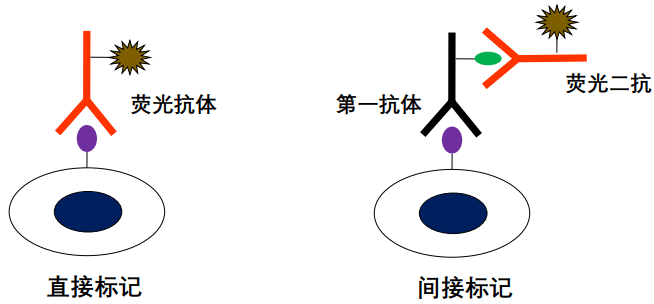
荧光素偶联抗体(免疫荧光染色):抗体上偶联荧光素(FITC、PE等),通过抗原抗体反应让目标细胞特异性的带上荧光。染色过程即抗原抗体反应过程。
荧光染料/荧光化合物:PI、DAPI等插入核酸链中;CFSE和蛋白质共价结合;Annexin V-FITC检测凋亡。
荧光蛋白:如GFP,不需要染色,直接检测。
免疫荧光染色主要包括直接和间接免疫荧光染色两种方法。间接标记的方法难以进行多色标记,而且操作复杂、信噪比高,所以流式抗体一般首选直标的荧光一抗。
细胞表面抗原标记
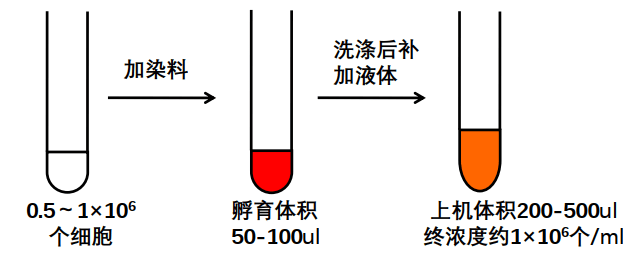
准备0.5~1×106个总细胞即可,上机检测时记录1~2万个目标细胞
目标细胞比例特别低时,或者标记步骤复杂需要多步离心时,相应细胞应多准备一些。
胞内抗原标记
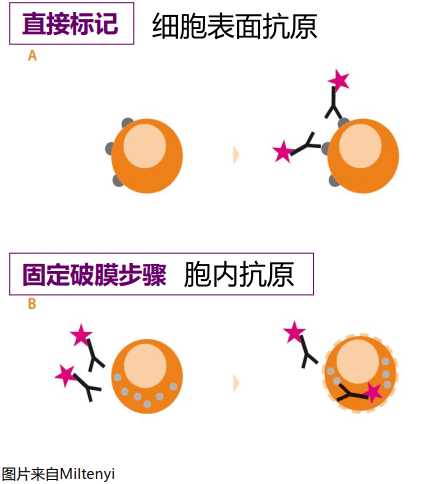
固定: 4%多聚甲醛
破膜/透化:可选择0.05%皂素(saponin)、0.01% Triton X-100、70% 乙醇
- 膜表面抗原染色:分别加入相应的荧光素标记抗体和适量细胞标本,充分混匀后避光孵育20-30min。
- 洗涤:加1ml PBS洗液,400g离心5min。
- 固定:去上清后加入500ul 4%多聚甲醛,固定20min。
- 透化:离心洗去固定剂后,加皂素500 ul,透化10min。
- 胞内抗原染色:离心洗去透化液后,加入相应荧光素标记抗体,混匀后室温避光孵育30 min。
- 洗涤:加1ml PBS洗液,400g离心5min。
- 上机检测:弃去上清后加入PBS 200-500 ul后上机检测。
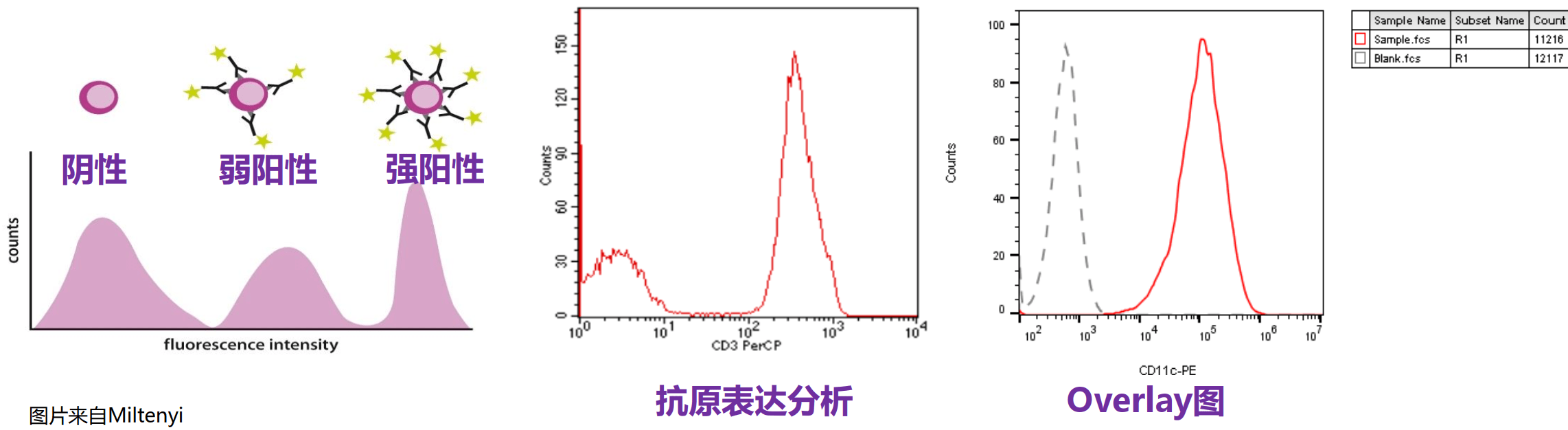
⭐对照组的设置
1 空白对照 Blank Control
空白对照即为未染色的细胞,用于区分细胞的自发荧光和阳性信号的位置;
流式实验中的光信号均为相对的,通过空白对照确定各通道的电压值。
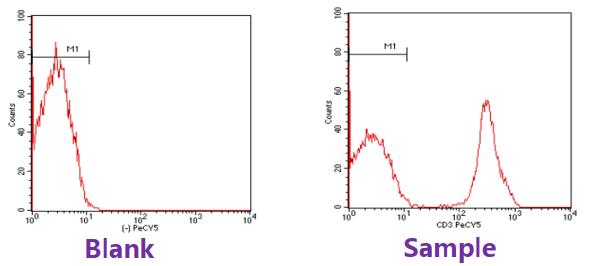
流式结果中荧光强弱是一个相对值,光电倍增管电压越大,电子信号越强;电压越小,信号越弱。
通过调节电压,使阴性对照管的荧光强度处于阴性的位置,实验组的荧光值都是相对对照组。
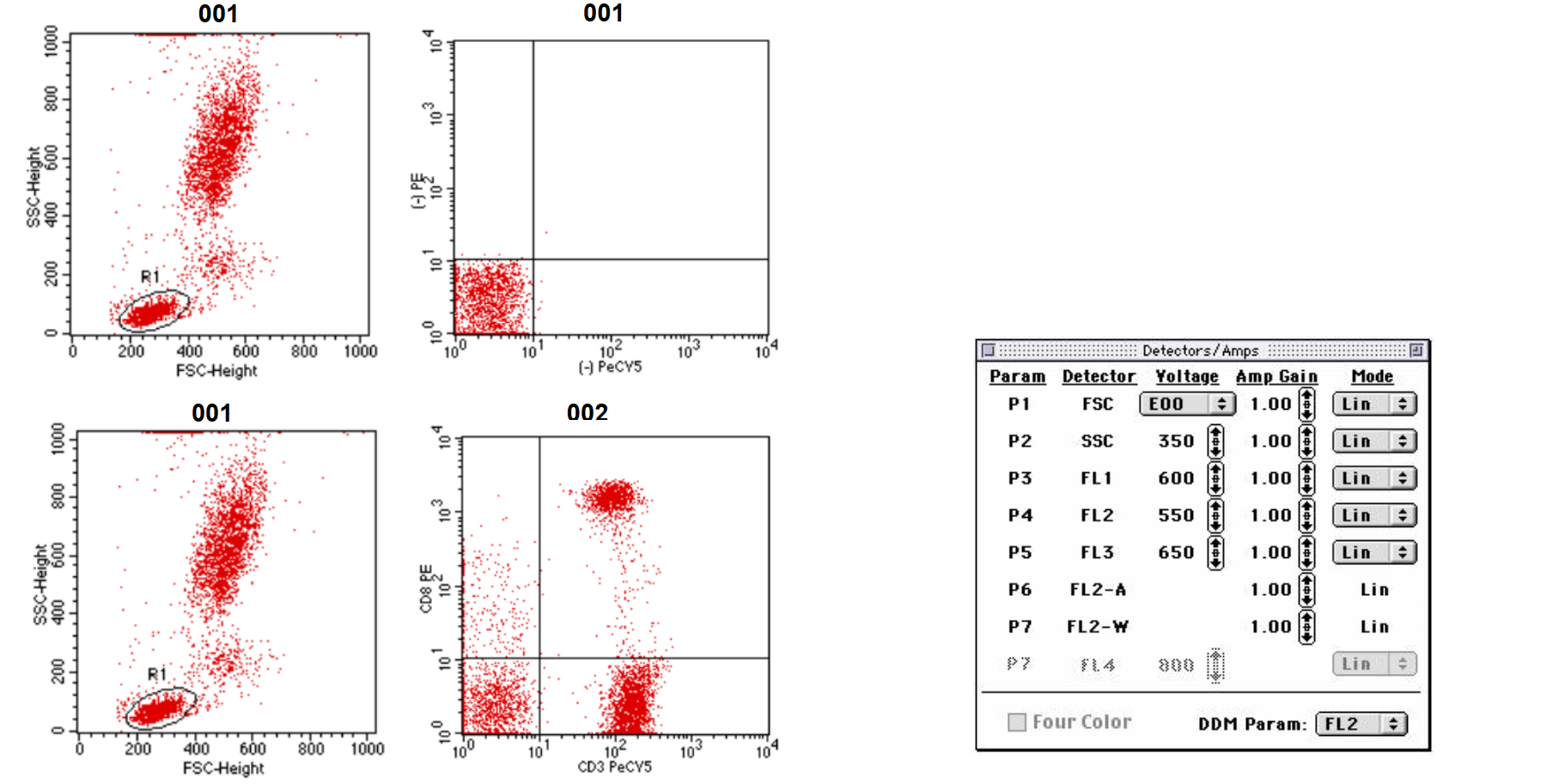
2 同型对照 Isotype Control
非特异性染色:抗体的Fc段可以与细胞表面的Fc受体非特异性结合;胞内染色时,游离抗体很难完全洗涤干净,造成非特异性染色。
同型对照是指使用与实验抗体相同种属来源、相同剂量及同种免疫球蛋白的相同亚型的抗体作为对照,用于消除抗体非特异性结合到细胞上而产生的背景荧光。
实验抗体:FITC-CD25单克隆抗体为鼠IgG1亚型抗体;
同型对照:未免疫小鼠血清纯化的IgG1,并标记FITC,相同剂量。
注:对于阴性和阳性分群很明显的抗原,可以不准备同型对照;优化抗体浓度、预先FcR抗体封闭细胞等步骤能降低非特异性染色
3 生物学对照 Biology Control
阳性对照:验证实验方案是否可行,如已验证肯定表达的细胞、已有的有效抗体。
阴性对照:最严谨的设门对照。如未刺激处理的细胞、肯定不表达某抗原的细胞等。
4 单标对照 Single Staining Control
两色或多色实验时可能需要设置单标对照,用于补偿的调节;
单标实验时不需要调节补偿。
5 荧光减一对照 FMO Control
Fluorescence Minus One。多色实验中,对于分群不明显的抗原,设置FMO对照用于区分阴性和阳性的界限。FITC的FMO对照即为单独准备一管细胞,仅不加FITC抗体、其他抗体都加。
光谱重叠与补偿
当细胞携带两种或两种以上荧光素时,理论上可通过滤光片的分离,使每种荧光素的发射光仅被相应的通道检测到。但由于目前使用的各种荧光染料都具有宽发射谱的特点,虽然发射光的峰值各不相同,但发射谱范围有一定的重叠,因而少量的荧光信号会被相近的另一通道检测到,这种现象就是光谱重叠(spectral overlap)。
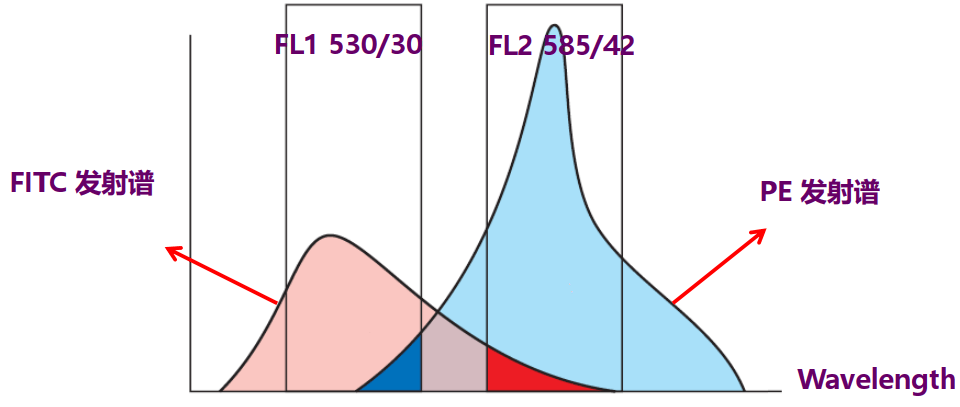
流式实验中,常利用电子技术和计算机软件设置的方法将串入相邻荧光通道的信号扣除,这种技术称为荧光补偿(fluorescence compensation)。
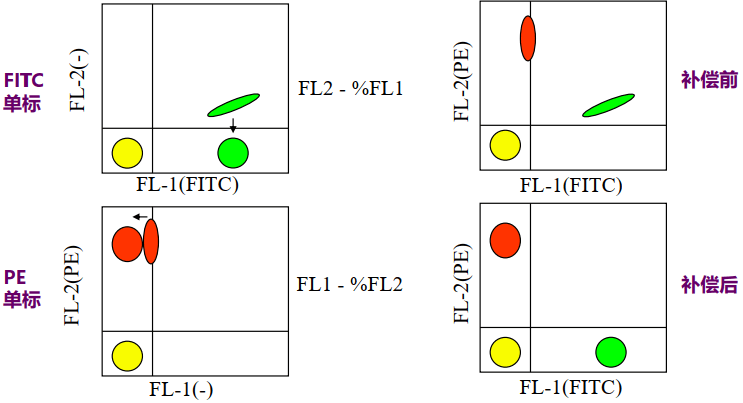
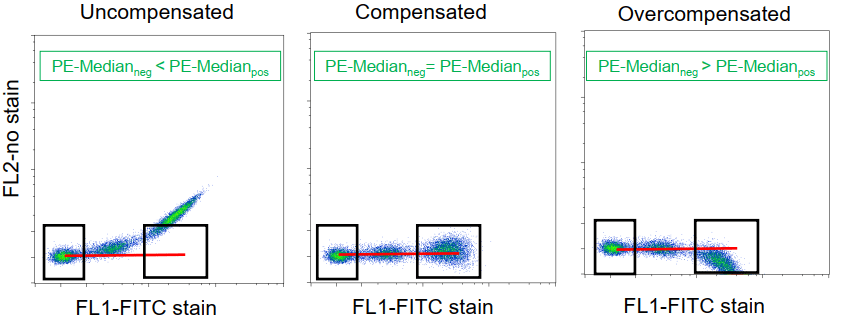
单染管的阴性群体和阳性群体在所需调节通道的荧光Median值相等时,补偿值最合适。
流式细胞术在生物医学中的应用
细胞表型和免疫细胞亚型检测
白细胞分化抗原是白细胞(包括血小板、内皮细胞等)在正常分化为不同谱系(lineage)和不同阶段以及活化过程中出现或消失的细胞表面标记分子。
分化群(cluster of differentiation, CD) :一类分化抗原的总称,进行流水编号,至2016年已至少有371种CD分子。
大多数白细胞分化抗原在生物进化中具有保守性,但是有些小鼠白细胞分化抗原和人类还是有所不同:某些人CD分子尚未在小鼠中确定;某些人和小鼠CD 分子编号相同,但功能有所差别。
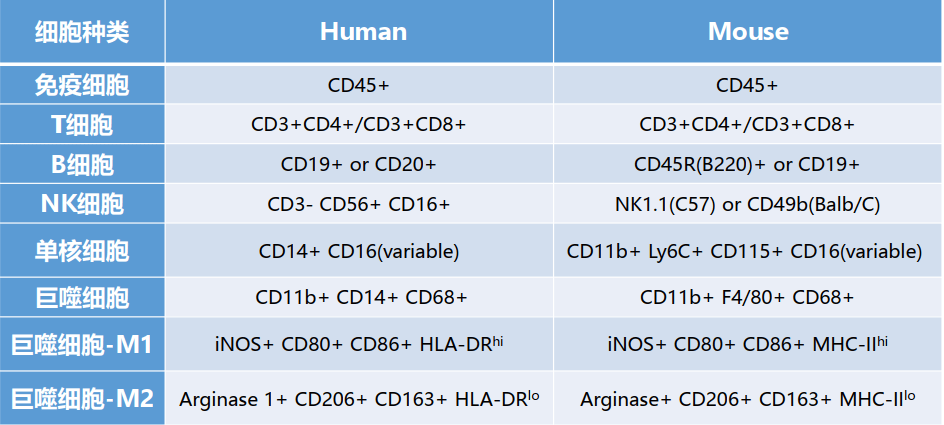
Human PBMC免疫细胞分型 :
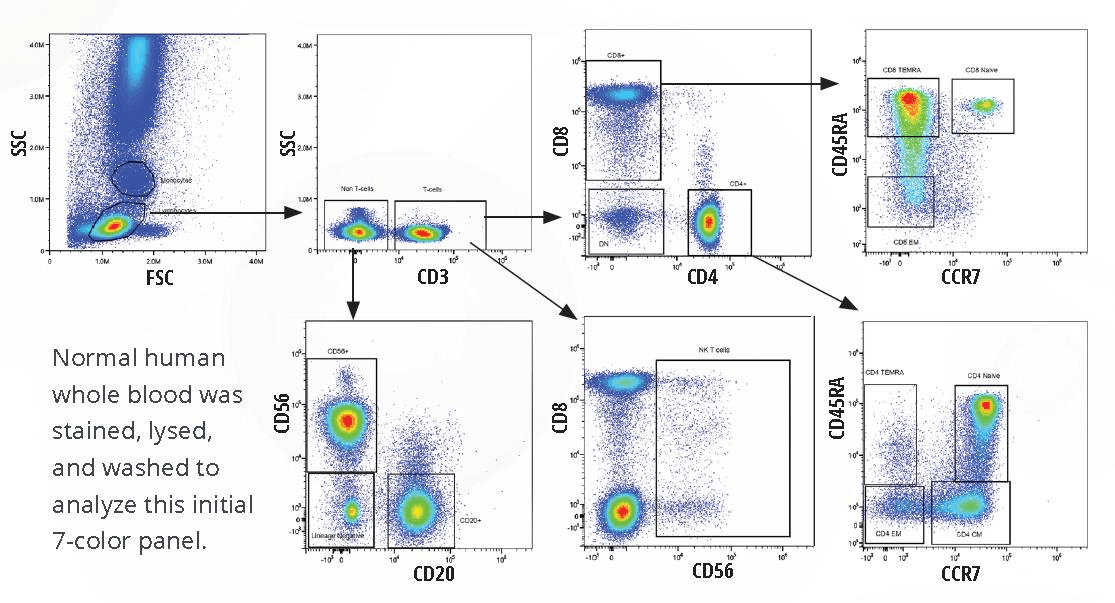
培养细胞的鉴定
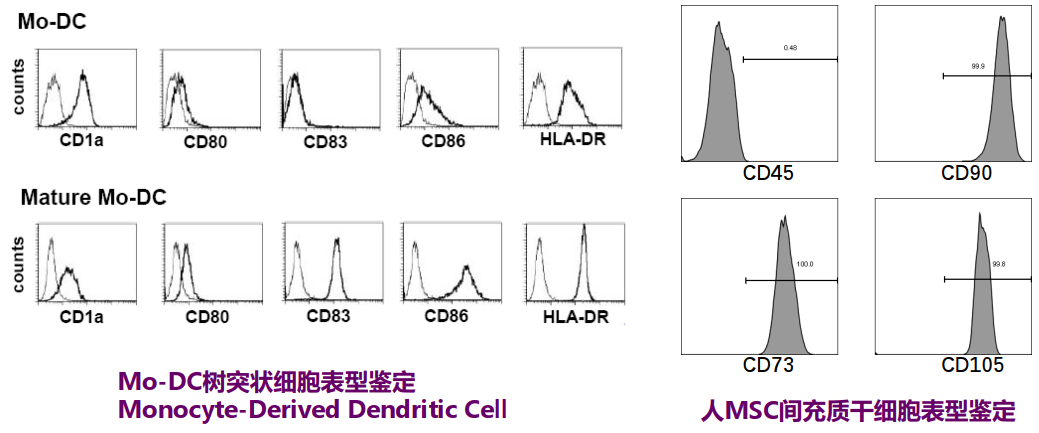
细胞健康和功能分析
细胞周期
处于不同细胞周期的细胞DNA含量不同,G0/G1期细胞含有二倍体量的DNA,G2/M期细胞含有四倍体量的DNA,而S期细胞DNA含量处于二倍体和四倍体量之间。
DNA荧光染料能与DNA结合,DNA含量的多少与荧光染料的结合量成正比,荧光强度反应了DNA吸收荧光分子的多少。通过流式检测就能反映细胞内DNA的含量,区分细胞周期的G0/G1期、S期和G2/M期细胞比例。
细胞周期分析核酸染料:
- 细胞膜非通透性染料:PI(碘化丙啶)、EB(溴化乙啶),不能进入完整细胞膜,标记时需要通过固定等方法增加细胞膜的通透性。
- 细胞膜通透性染料:Hoechst,能染活细胞的DNA,但需紫外激光激发。
PI标记法检测细胞周期:经典方法加70%乙醇固定过夜,或者加入其它透化剂增加通透性;需要加RNase,去除RNA对DNA的干扰。
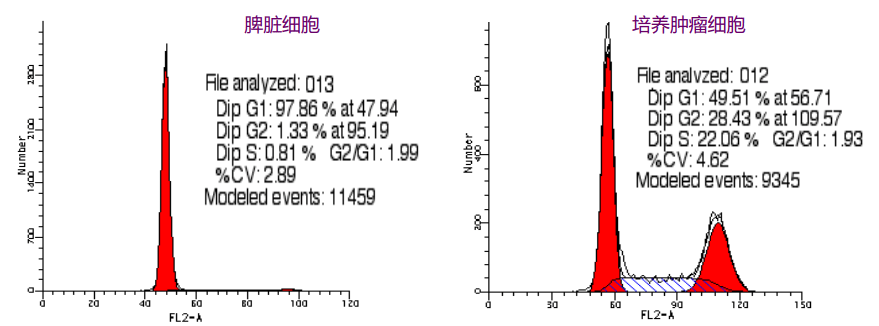
通过流式检测,能得出G0/G1期、S期和G2/M期细胞比例。
增殖指数(proliferous index, PI):指处于S期和G2/M期细胞之和占总细胞的比例,反映了细胞的增殖能力。
CV值(变异系数):衡量仪器测量分辨率和精度的指标。
细胞凋亡
细胞凋亡,也称细胞程序性死亡,是细胞受基因调控的一种主动性的、高度有序的结束自己生命的过程。
凋亡细胞在形态学和生化上有明显的特征,如细胞皱缩、核固缩、细胞膜卷曲、DNA片段化、线粒体电位发生变化。根据这些特征,流式有多种方法能定性及定量的检测细胞凋亡情况。
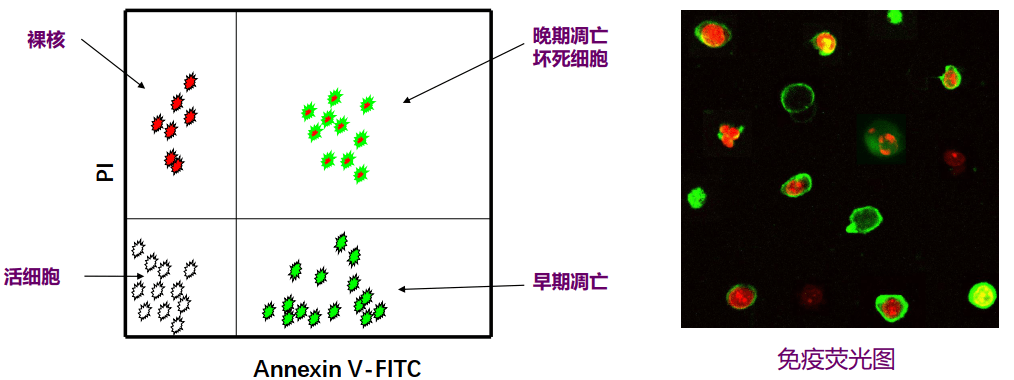
正常细胞膜是不对称性的,胞浆面含有带负电的磷脂(如磷脂酰丝氨酸, PS)。早期凋亡时,细胞表面不对称性发生改变,PS外翻到胞外侧。
Annexin V/PI双染法
Annexin V是一种Ca2+依赖性的对PS有高度亲和力的磷脂结合蛋白,可作为探针识别膜表面是否有PS,从而识别凋亡细胞。
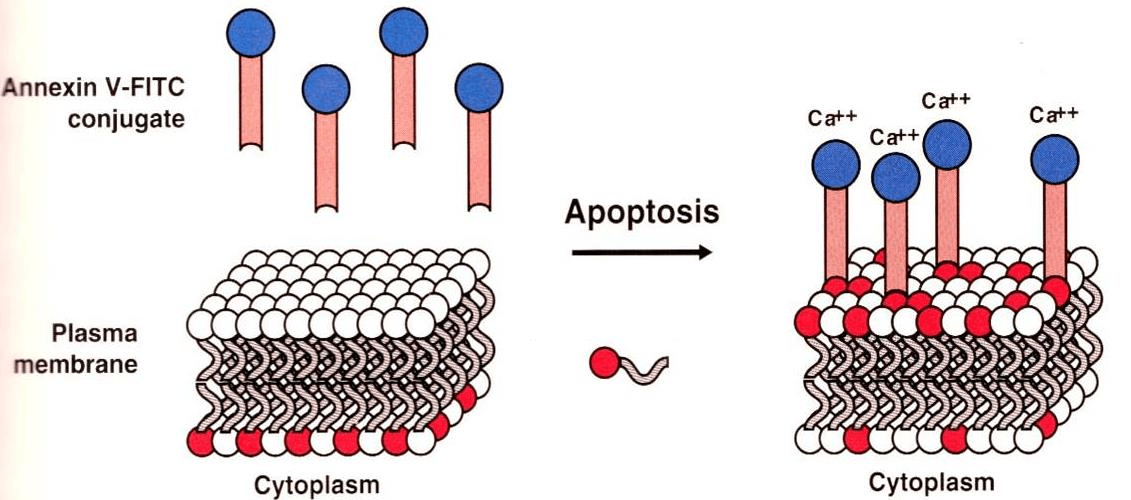
早期凋亡细胞膜仍是完整的,PI不同透过细胞膜,所以为PI阴性:
细胞增殖
细胞增殖(proliferation)是细胞生命活动的重要特征之一。检测细胞增殖的方法主要有:
- MTT检测法
- 胸腺嘧啶核苷(3H-TdR)掺入法
- 流式细胞术
- 细胞周期法
- 相对计数法/绝对计数法
- 示踪染料标记法
- BrdU/EdU标记法
- 增殖蛋白检测(Ki67)
示踪染料法检测增殖
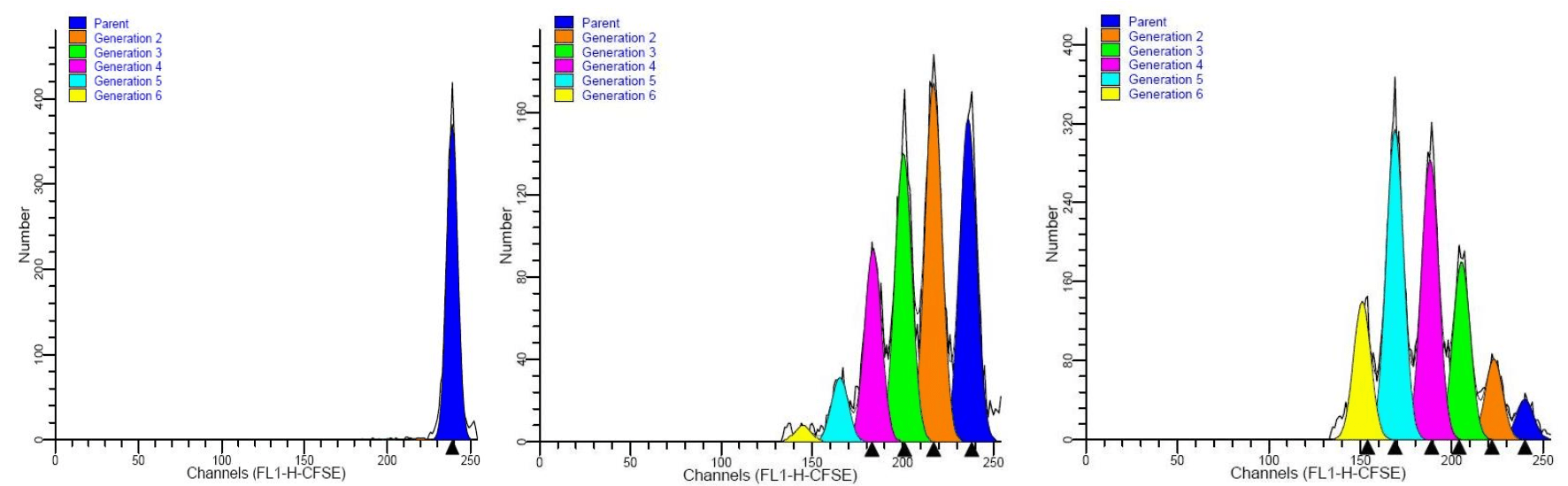
示踪染料(如CFSE/CellTrace等)能与细胞发生非特异性的稳定结合,标记细胞后对细胞没有很强毒性,被激发后能发出很强的荧光,并且非常稳定,只有当细胞分裂时,母细胞内的染料会被平均分配到子细胞中,细胞的荧光信号减少一半。
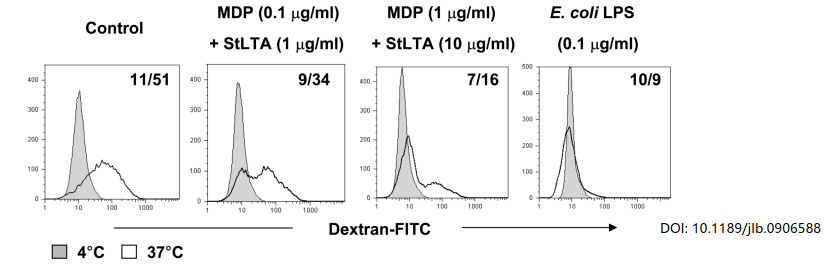
细胞吞噬
巨噬细胞、中性粒细胞和树突状细胞等都具有很强的吞噬功能,检测吞噬功能是免疫学研究的重要内容
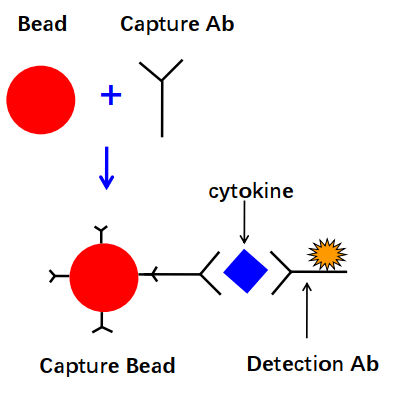
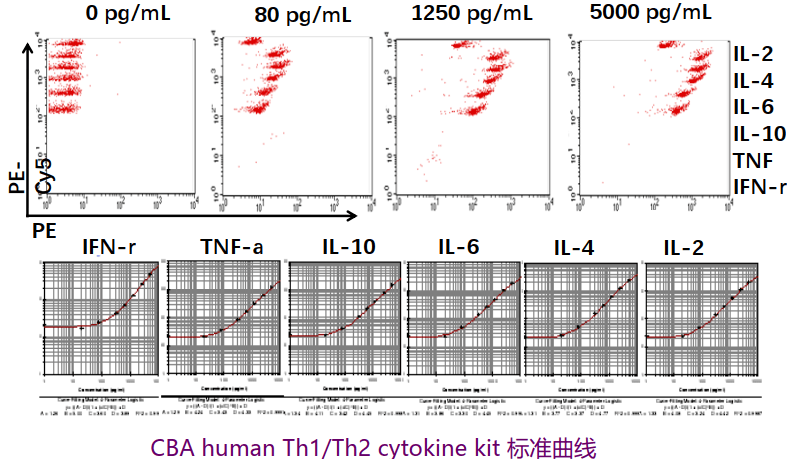
细胞因子定量检测-CBA技术
CBA(cytometric bead array, 流式微球阵列)是新发展起来的能定量检测胞外游离可溶性成分(如细胞因子等)的新方法。CBA应用领域包括血清、血浆、泪液等体液标本以及细胞培养上清液中多种可溶性成分的检测。
微球上包被细胞因子抗体后形成捕获微球(capture bead),捕获微球上的捕获抗体(capture antibody)能与样本中相应的细胞因子特异性结合。这样捕获了细胞因子的微球就类似于一个细胞,加入相应的荧光素检测抗体形成“三明治”式夹心复合物,上流式后就能得到细胞因子的含量。
技术优点:能同时检测多种目的蛋白;样本需求量小;更高的灵敏度和更好的重复性;操作简单省时省力。
CBA微球是包被有荧光染料的,一系列荧光强度不同的微球就能同时检测多种细胞因子
CBA kit中含有已知浓度的标准品,测定前将标准品稀释成不同浓度,制作标准曲线。
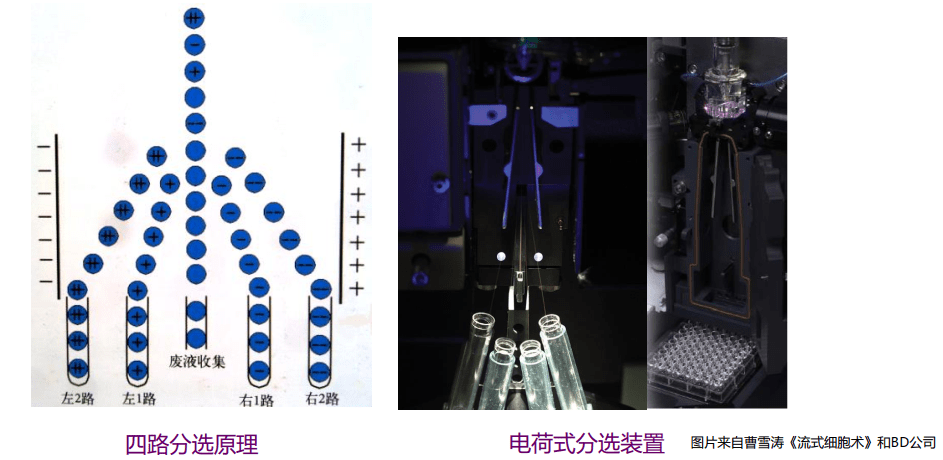
流式分选
电荷式分选:超声振动器(15-100kHz);液流充电系统;高压偏转板;收集装置(流式管、培养板)
连续的液流被震荡成一个一个的小液滴,细胞包裹在液滴中;
对包裹目标细胞的液滴的准确充电是分选的关键。
流式分选和磁珠分选的比较
| 比较项目 | 流式分选(FACS) | 磁珠分选(MACS) |
|---|---|---|
| 设备要求 | 分选型流式细胞仪 | 专用的磁铁和柱子 |
| 操作员要求 | 要求高,需专门培训 | 操作简单,要求不高 |
| 试剂 | 荧光素偶联抗体 | 磁珠结合抗体 |
| 对细胞刺激 | 刺激大 | 刺激小 |
| 多参数分选 | 可以 | 不可以 |
| 低表达群细胞分选 | 可以 | 不可以 |
| 胞内荧光分选 | 可以 | 不可以 |
流式分选结合磁珠分选的方法,常应用于分选低比例细胞群。如分选调节性T细胞CD4+ CD25+ CD127low ,先用磁珠分选纯化CD4+ T细胞(预富集),再用流式分选的方法分选CD4+ CD25+ CD127low调节性T细胞
免疫细胞亚群分选
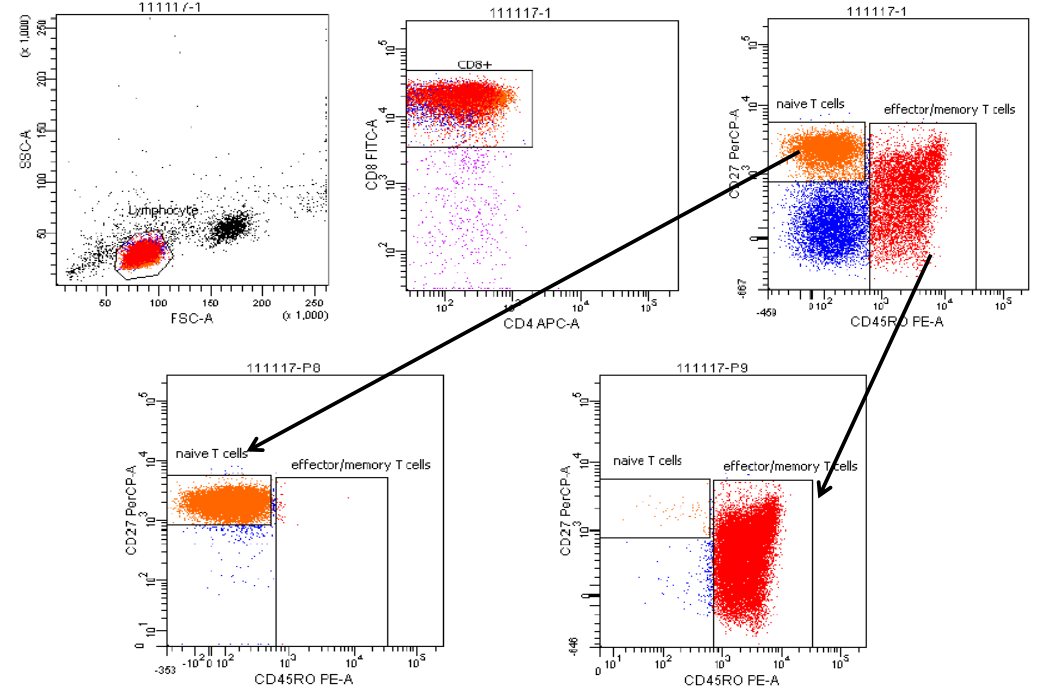
GFP阳性稳转株分选
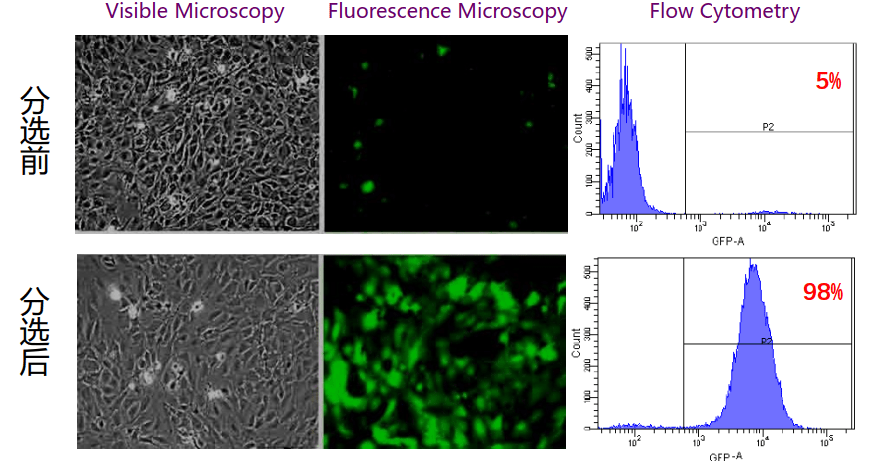
B站找了个视频供参考:








- 最新
- 最热
只看作者