酵母双杂交(yeast two-hybrid)
酵母双杂交系统是在真核模式生物酵母中进行的,研究活细胞内蛋白质相互作用,是一种具有很高灵敏度的研究蛋白质之间关系的技术。
当我们将已知基因编码的蛋白作为诱饵,在选定的cDNA文库中筛选与诱饵蛋白相互作用的蛋白,从筛选到的阳性酵母菌株中可以分离得到AD-LIBRARY载体,并从载体中进一步克隆得到随机插入的cDNA片段,并对该片段的编码序列在GENEBANK中进行比较,研究与已知基因在生物学功能上的联系。
原理解读:
DNA-binding domain(BD)能够结合上游调控序列(UAS),但其本身无法激活基因表达,而Activation domain(AD)具有激活基因表达的能力,但是无法独立的与DNA结合。通过构建基因表达载体,将bait与BD连接到一起,fish与AD连接在一起,导入酵母菌中。
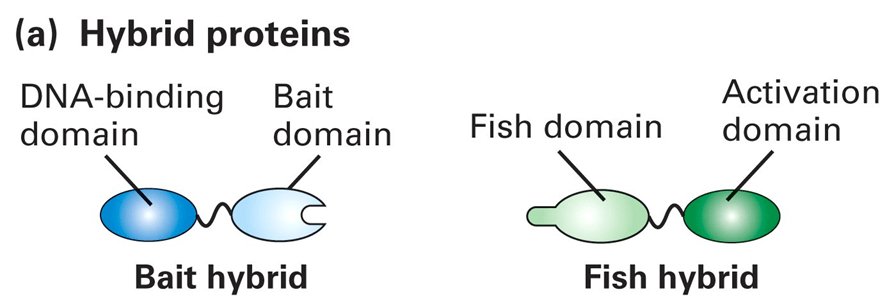
下游通常需要加入报告基因,如图中以HIS为例:
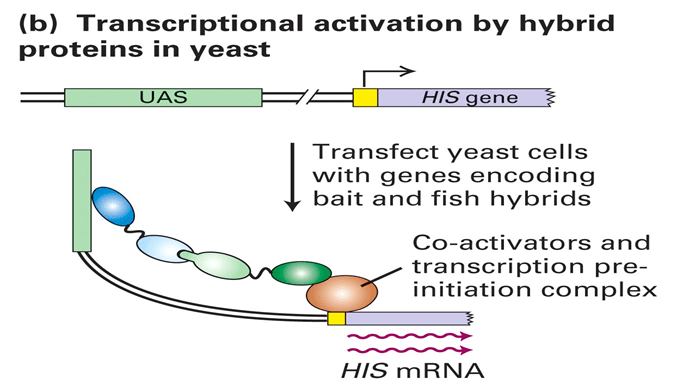
如果bait和fish存在相互作用,则形成的 Hybrid Protein 能够结合到UAS区域并且激活基因表达,通过筛选报告基因表达的酵母菌即可得到相互作用信息。
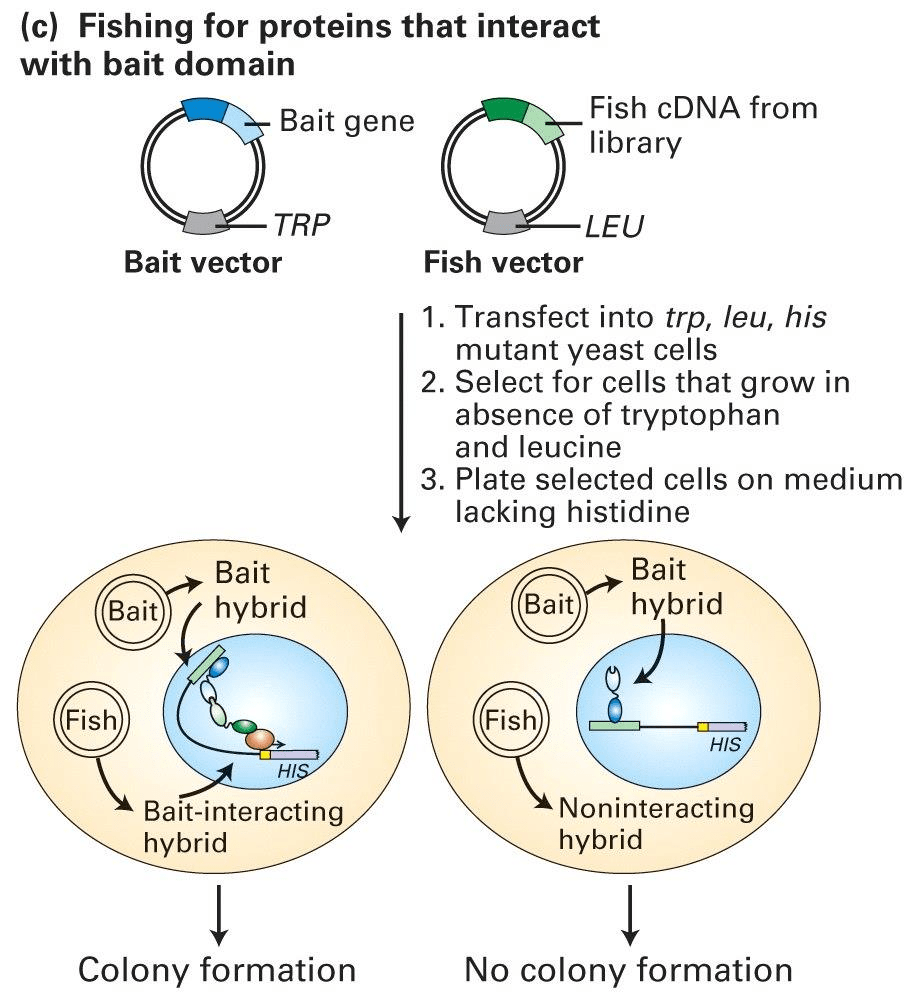
图中展示的是一种比较常用的筛选方法,使用his作为报告基因,当bait和fish两个蛋白存在相互作用时,组氨酸就能够表达,如果酵母菌能够在不含外源性组氨酸的培养基中形成克隆,则其内部的bait和fish是存在相互作用的。(需要通过pcr进一步检测)
GST-pull down
GST pull-down 实验是一个行之有效的验证酵母双杂交系统的体外实验技术。其基本原理是将靶蛋白-GST融合蛋白固化在谷胱甘肽亲和树脂上,充当一种“诱饵蛋白” 。当目的蛋白溶液过柱,可从中捕获与之相互作用的“捕获蛋白” (目的蛋白),洗脱结合物后通过SDS-PAGE电泳分析,从而证实两种蛋白间的相互作用或筛选相应的目的蛋白,“诱饵蛋白” 和“捕获蛋白” 均可通过细胞裂解物、纯化的蛋白以及体外翻译等方法获得。
⭐免疫共沉淀 Co-IP
以抗原和抗体的专一性作用为基础,用一种特定蛋白质的抗体与总蛋白质样品溶液混合,将抗原-抗体复合物沉淀下来,在此过程中与抗原相互作用的蛋白质也共同沉淀下来。该复合物经过蛋白质电泳分离后,再对这些蛋白质加以分析。该技术可定性和定量研究两种及两种以上蛋白质在细胞内的相互作用,也可用来分离可能存在的蛋白质复合物。
结果解读:
下图是验证Cax与p65的相互作用:
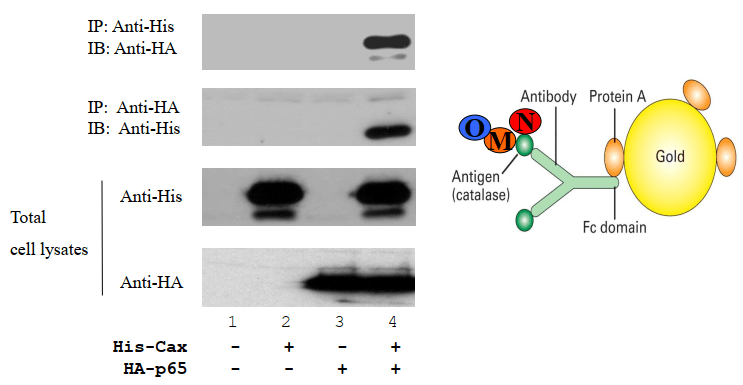
构建基因表达载体的时候将his标签连接给Cax,HA标签连接给p65,便于后续实验。
该图一共分四组,分别做了两次免疫共沉淀正反验证相互作用。总细胞裂解液即为Input,表明总蛋白样品中存在相应的目的蛋白。实验4表明相互作用的存在:用His标签沉淀,wb中发现有HA的条带,反过来用HA沉淀,WB中也有His的条带,说明两者能够结合。
设置Input组和IgG组的目的:
Input组:证明靶蛋白X和预测的相互作用蛋白Y是存在于蛋白样品中的。
IgG组:排除免疫球蛋白本身的亲和作用。有条带表明可能是假阳性。
操作流程:

免疫荧光 IF
检测蛋白质的亚细胞定位和互作蛋白的共定位
荧光共振能量转移(FRET)
荧光共振能量转移是距离很近的两个荧光分子间产生的 一种能量转移现象。当供体荧光分子的发射光谱与受体荧光分子的吸收光谱重叠,并且两个分子的距离在10nm范围以内时,就会发生能量转移,使得供体的荧光强度比它单独存在时要低的多(荧光淬灭),而受体发射的荧光却大大增强(敏化荧光)。
检测FRET的效率,代表分子之间的距离,指示分子间是否有相互作用。
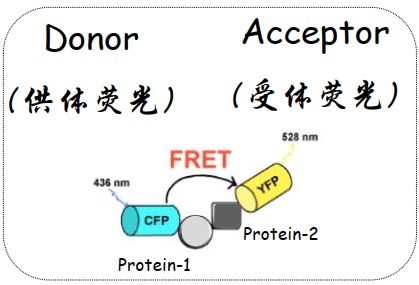
两个必须条件:两个分子距离<10nm;D的发射光谱与A的激发光谱必须有显著的重叠,一般要>30%
检测FRET效率的方法:
-
敏化发射法Sensitized emission:共振能量转移后,受体发射能量的增强
-
受体光漂白Acceptor Photobleaching FRET :受体漂白后,由于共振能量不能转移,供体能量的增强
-
FLIM(fluorescence lifetime imaging microscopy):(略)供体荧光时长的缩短













暂无评论内容